Fundamental för all vetenskaper, förstå hur livet fungerar.
Vilken riktning tar en kemisk reaktion och kan man kvantifiera det? Finns det en benägenhet för en viss riktning och hastighet?
Hänger ihop med drivkraften som finns i en viss reaktion.
- de kan beskriva kvantitativt
- den termodynamiska aspekten
Förhållande mellan
- tryck
- volym
- energi
- temperatur Ursprung från konstruktion av ångmaskiner Allmänt regelverk
Historik
- värme är kopplat till rörelse av små partiklar
- värme är ett form av arbete
- carnot diskuterade effektiviteten hos en ideal motor och diff temperatur
- går aldrig att konstruera en 100% effektiv maskin, finns alltid en liten bit som går förlorad i värme och finns ej överskott
- defintion av oordning (entropi) och slumpmässig fördelning
- första och andra huvudsatsen
- gibbs introducerade begreppet ensemble (N möjliga tillstånd), samband mellan kemisk energi och möjliga samband
TD talar om vad som kan ske, inte hur fort Tre olika system (fet kan ej utbyta med omgivningen)
- isolerat (energi materia)
- termos
- stängt (energi materia)
- glas med lock
- öppet (energi materia)
- glas utan lock
celler och organismer är öppna system
Reaktionstyper
- exergon frisättandet av energi (tex värme)
- eldar med ved
- exergon = all typ av energi
- exoterm = värme
- (negativ)
- jämnvikt A + B <> C + D
- finns ingen utbyte av energi mellan systemet och omgivningen
- till exempel, vatten som stått ett tag i rumstemperatur, kan inte längre utbyte energi med omgivningen
- endergon absorbation av energi (tex värme)
- främställning av socker mha fotosyntes
- (positiv)
Termodynamikens fyra lager
Genom många försök i kemin har man
Definitionslag (0)
Om två system är i jämvikt med ett tredje system är det jämvikt med varandra Viktig definition, det tillåter att man kan mäta system t.ex. termometer, för jämförelse
- gäller en aspekt på ett system
- koncentration jämvikt != värme jämvikt
1. Energi omvandlas varken skapas eller förstörs
Total energin i universums ändras inte
Summan av all energi i ett separat system behålls
2. System tenderar att gå från organiserade till oorganiserade tillstånd
Universums totala entropi ökar Blir ett system ordnat måste ett annat be oordnat.
3. Entropi av ett perfekt (kristallint) ordnat ämne går till 0 när T → 0 K
Vid denna temperatur är alla partiklar ordnade i sitt mest stabila tillstånd, utan rörelse eller oordning. Eftersom entropi mäter systemets oordning eller antalet möjliga mikrotillstånd, finns bara ett enda tillstånd kvar - den fullständigt ordnade kristallen. Därför blir entropin S = 0. Detta ger en naturlig nollpunkt för entropiskalan och förklarar varför det är omöjligt att nå 0 K: all energiöverföring skulle upphöra och ingen ytterligare minskning av entropin vore möjlig.
Ju mindre energi vatten har, ju mer oordnad är den oordning = rörelse? Ordningen gäller också tid/rörelse
Entalpi
\Delta H = H_{efter} - H_{fore) <0
“energiinnehållet”, en reaktion som kan ske spontant.
H: Entalpi, värme som frigörs/absorberas under en kemisk reaktion U: Intern energi, summan av potentiell och kinetisk energi P: tryck V: volym
Energiinnehållet beror på bindningarnas energi
Intern energi (E) eller (U) i ett system
Alla energi kan utbytas:
- ∆E är förändring i inre energi
- E1 är intern energi i tillstånd 1
- E2 är intern energi i tillstånd 2
- q är energi (värme) som absorberas av systemet från omgivningen
- w är arbete som görs på systemet från omgivningen
Reaktion t.ex. druvsocker + syre → koldioxid och vatten
-
Druvsocker → etanol + koldioxid
-
Etanol + syre → koldioxid + vatten
Dvs, man kan dela upp en reaktion i mindre steg
Spontan reaktion
Ökar alltid entropin
entropi ett mått på oordningen i ett system
Spontan är gynnsam med tillräckligt med drivkraft för att kunna ske, de är enkelriktade
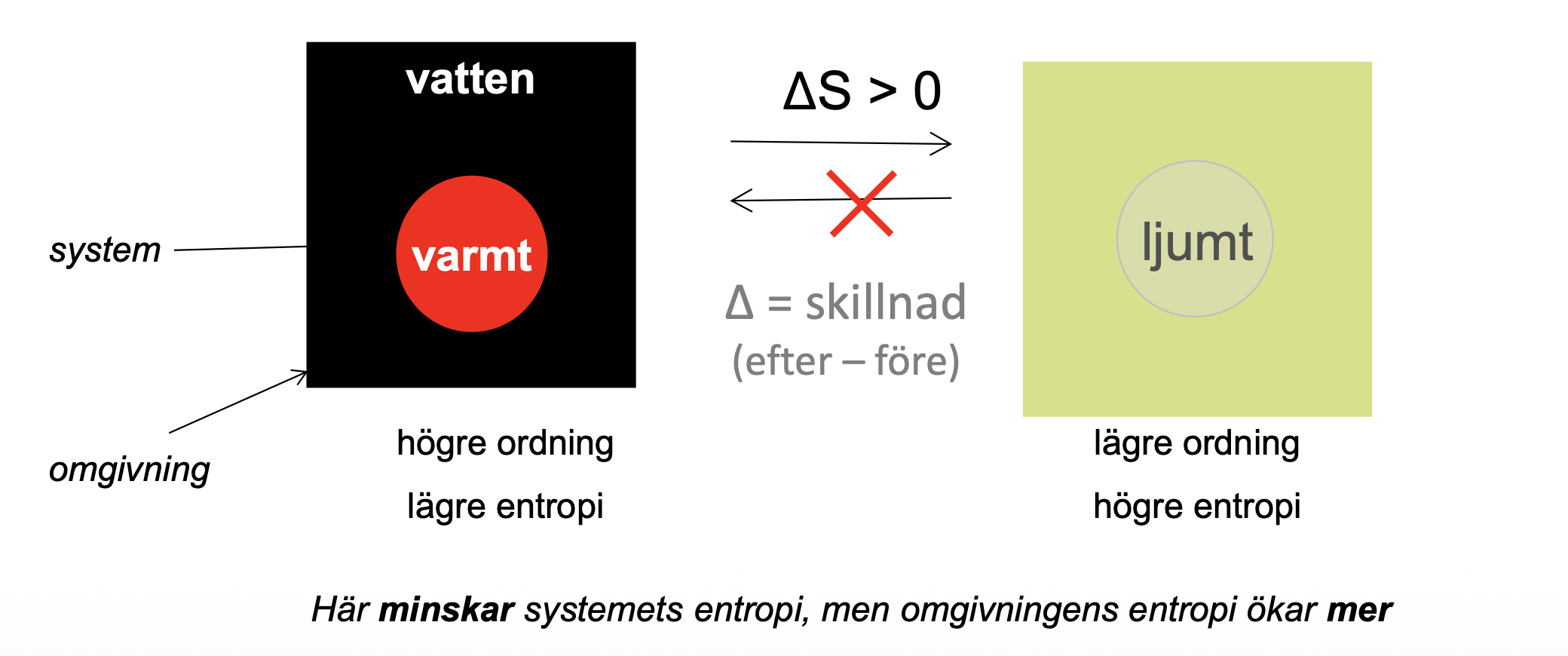
Entropin ökar eftersom det finns fler möjliga sätt att vara oordnad på än ordnad. T.ex. korthus
Diffusion
Spontan reaktion som äger rum när t.ex. vätskor med egenskap skilt från omgivningen sprids, blandas och jämnas ut. Ofta orsakas diffusion av någon slags slumpvandring
Browns rörelse
…
Andra sätt att förändra entropin
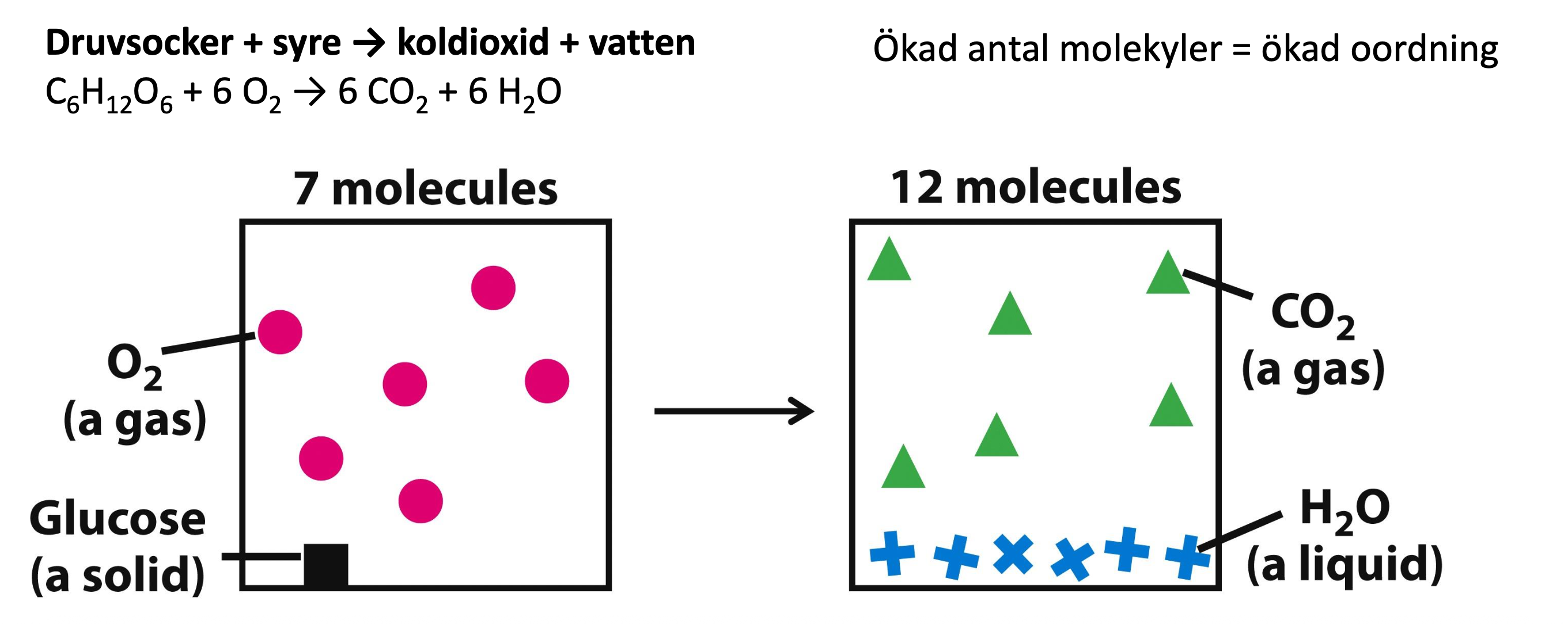
Ju mer molekyler ju mer oordning
Information är negativ entropi
 gäller också information som är lagrad i t.ex. DNA, sker inte spontant, har investerat jättemycket energi för att selektera de sekvenser som fungerar bäst
gäller också information som är lagrad i t.ex. DNA, sker inte spontant, har investerat jättemycket energi för att selektera de sekvenser som fungerar bäst
Fri energi
Enkelt sätt att förutsäga en kemisk reaktion
- H (entalpi): systemets värmeinnehåll - den energi som frigörs eller upptas vid reaktionen.
- S (entropi): systemets grad av oordning eller antalet möjliga mikrotillstånd. ∆G < 0 ⇒ nettoreaktion: A → B ∆G > 0 ⇒ nettoreaktion: A ← B Vid jämvikt är ∆G = 0
Vid exergon reaktion
- ∆G anger vilket max arbete (energiomvandling) systemet kan göra
- ∆G < 0 Vid endergon reaktion
- ∆G > 0
- ∆G anger den minimala arbetet (energiomvandling) som krävs
ΔG = ΔH - TΔS
- ΔG (Gibb’s fri energi ändring) → kJ/mol
- ΔH (Enthalpi ändring) → kJ/mol
- ΔS (Entropi ändring) → kJ/mol x K
- T (Temperatur i Kelvin)
∆G beror på • vilka ämnen som reagerar • ämnenas resp. koncentrationer För jämförelse mellan reaktioners benägenhet att ske finns:
∆G0 dvs ∆G när alla ämnen i reaktionen har koncentrationen 1 M, temperaturen är 25 ℃ (298 K) och trycket 1 atmosfär. ∆G0 är specifikt för en given reaktion. Olika reaktioner har olika ∆G0
gör att man jämföra olika reaktioner
I biokemiska förhållande har man pH 7 =
Kemisk jämvikt är när förhållandet mellan reaktanter och produkter inte ändras längre, ∆G = 0
Tillståndet för jämvikt när man förbrukat allt
jämviktskonstantent är specifik för varje reaktion i en given temperatur
∆Go = -RTln(Keq)
- K = jämviktskonstant
- R = gaskonstanten
- T = temp i grader Kelvin ln, naturliga logaritm och sålunda är K = e -∆G0/RT
Om ∆G0 < 0 blir K > 1 Om ∆G0 = 0 blir K = 1 Om ∆G0 > 0 blir K < 1
Får vi räkneuppgifter. Det är mest teoretiskt, det är ingenting ni ska räkna ut. Behöver förstå koncepten gör mig nöjd.
Behöver inte kunna lagar med gaskonstanten.
ATP → ADP + Hur stort är ∆G för ATP hydrolys i RBK? 37 grader C, [ATP] = 2.25mM, [ADP] = 0.25 mM, [Pi] = 1.65 nM R(Gaskonstantent) = 8.315J/mol, ∆G0 = -30.5kJ/mol