Översikt
- Cori-cykeln illustrerar hur muskler och lever samarbetar: muskler frisätter laktat som levern omvandlar till nytt glukos.
- Kroppens energireserver:
- triglycerider i fettväv ≈ 83 %
- proteiner ≈ 15 % (nedbrytning medför muskelförlust, inget önskat lager)
- glykogen ≈ 0,9 % i muskler och 0,3 % i lever
- Glykogen binder vatten och är därför betydligt mindre energitätt än fett (≈7× skillnad).
- Hjärnan kräver kontinuerlig glukostillgång i normalläge.
Struktur och byggstenar
- Glykogen består av glukos kopplat via 𝛼-1,4-bindningar med 𝛼-1,6-förgreningar var 8–12:e enhet.
- Kedjorna byggs och bryts vid de icke-reducerande (4′) ändarna; den reducerande (1′) änden sitter kovalent fast i glykogenin.
- Hydrolys klyver 𝛼-1,6-bindningar i grenpunkter.
- Fosforylys (med oorganiskt fosfat) klyver 𝛼-1,4-bindningar och lämnar glukos-1-fosfat.
Glykogenolys – översikt
- Fosforylys: glykogenfosforylas spjälkar glukos-1-fosfat från icke-reducerande ändar.
- Remodellering: debranching-enzymet flyttar förgreningar så att fler enheter blir åtkomliga.
- Isomerisering: fosfoglukomutas konverterar glukos-1-fosfat till glukos-6-fosfat.
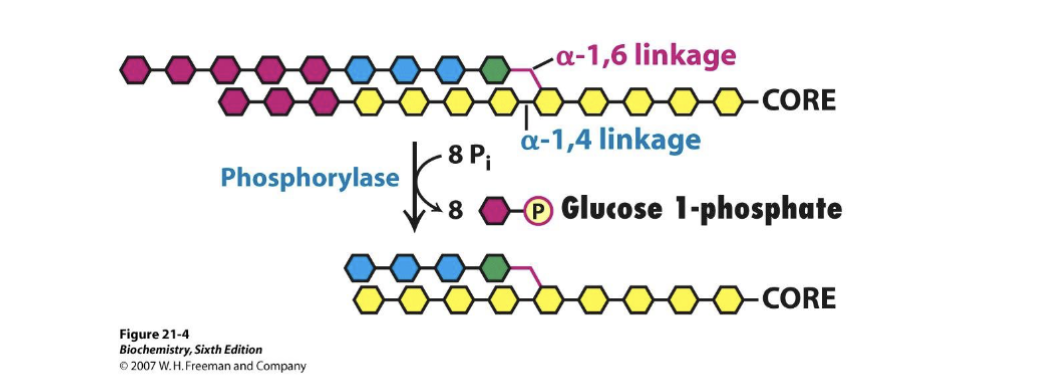
När fyra glukosenheter återstår före en gren tar steriska hinder stopp för fosforylaset. Utan remodellering hade endast cirka en tredjedel av glykogenlagret varit åtkomligt.
Debranching-enzymet
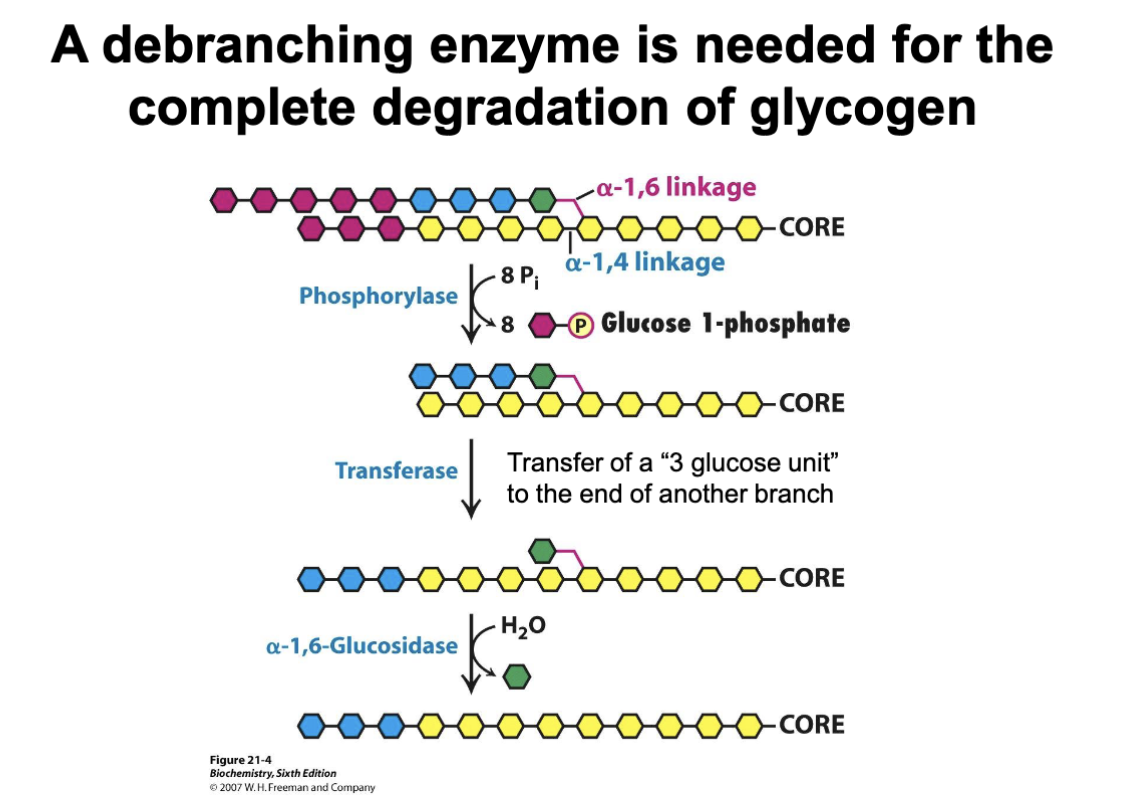
- Har två aktiviteter. Transferasdelen flyttar en trimer av glukos från en kort gren till en längre intilliggande kedja.
- Den sista glukosen i förgreningen klyvs genom 𝛼-1,6-glukosidasaktivitet och lämnar som fritt glukos (övriga enheter lämnar som glukos-1-fosfat).
Fosfoglukomutas
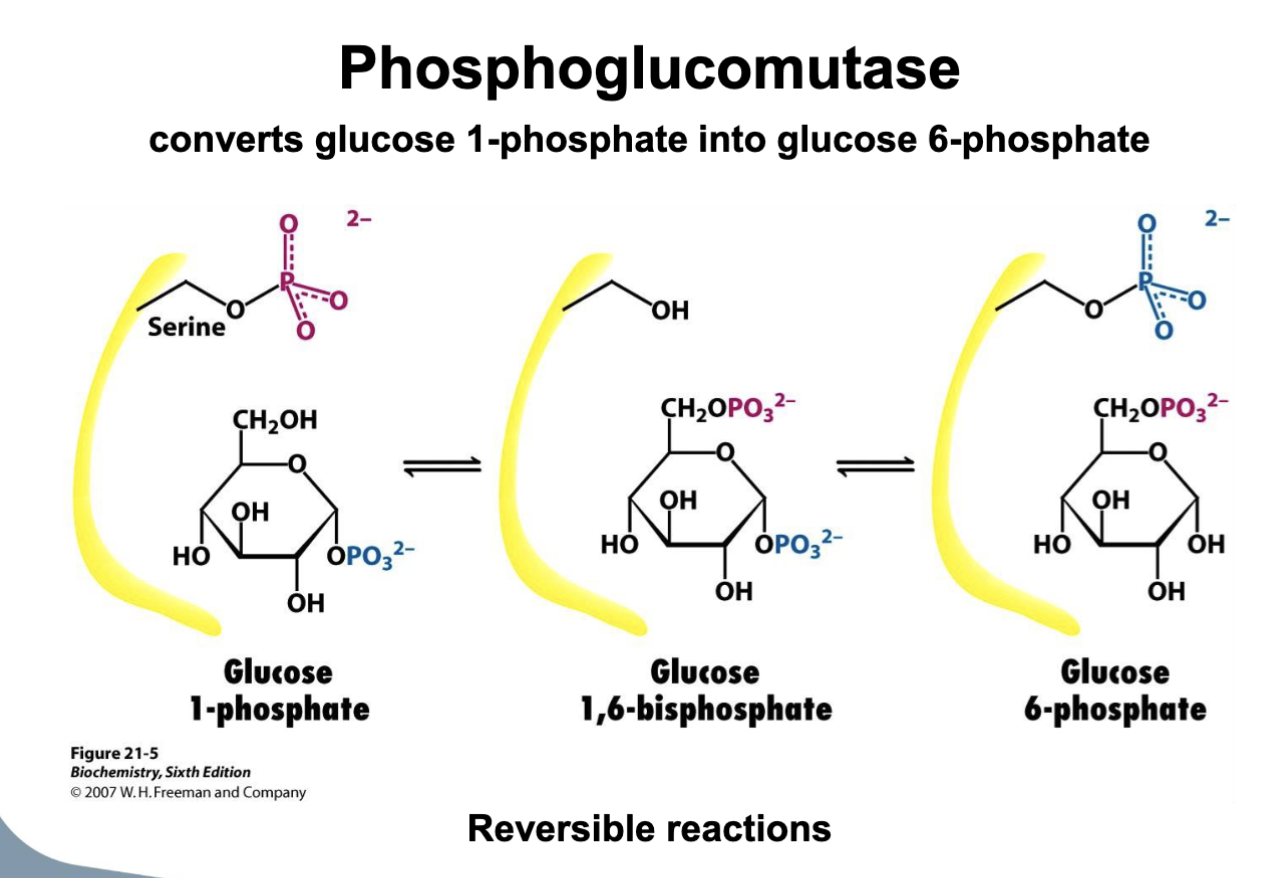
- Flyttar fosfatet från C1 till C6 via ett fosforylerat enzymintermediat.
- Reaktionen är reversibel, kräver inget ATP och ger glukos-6-fosfat som kan gå vidare till glykolys, pentosfosfatvägen eller gluconeogenes.
Glukos-6-fosfatas
- Glykogen byggs och bryts ner i cytosolen, men glukos-6-fosfatas finns i ER-membranet i lever och njure.
- Enzymet omvandlar glukos-6-fosfat till fritt glukos, som lämnar cellen via GLUT2. Detta är ett centralt steg i både glykogenolys och glukoneogenes.
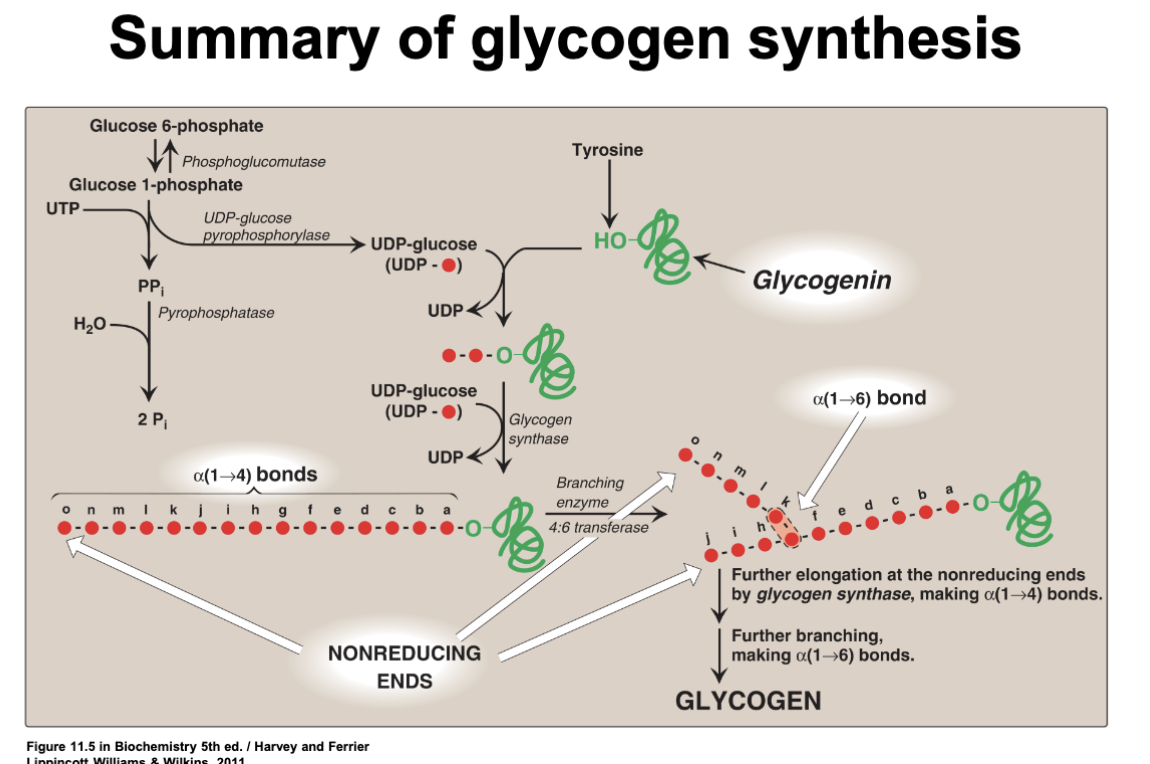
Glykogensyntes – fyra huvudsteg
- Aktivering: glukos-1-fosfat + UTP → UDP-glukos + PPi via UDP-glukospyrofosforylas; PPi hydrolyseras och driver reaktionen framåt.
- Initiering: glykogenin autokatalyserar addition av glukos (från UDP-glukos) på en tyrosinrest tills en primer på minst fyra enheter bildats.
- Elongering: glykogensyntas binder UDP-glukos till icke-reducerande ändar genom 𝛼-1,4-bindningar.
- Förgrening: branching-enzymet flyttar 6–7 glukoser från en lång kedja och skapar en 𝛼-1,6-förgrening cirka fyra enheter bort från befintlig gren. Grenpunkter kan inte placeras för tätt.
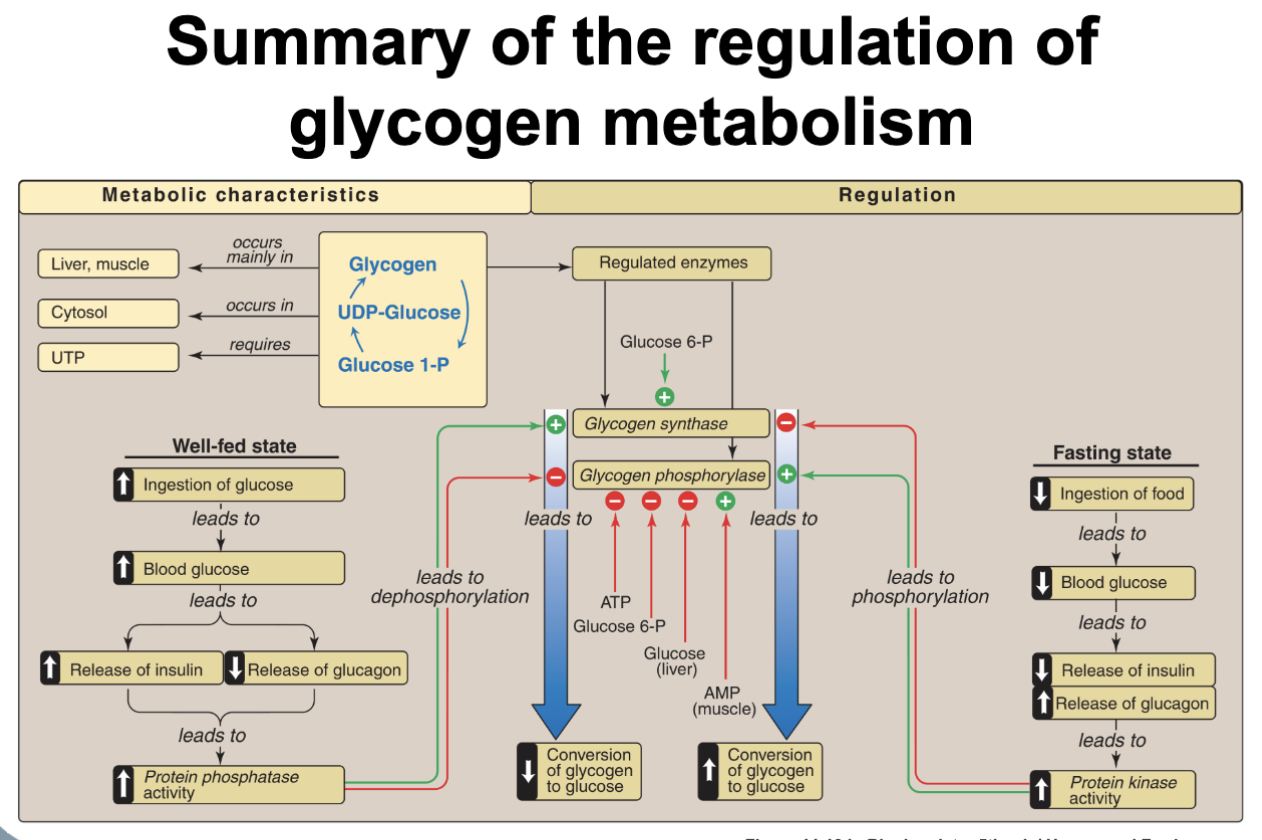
Regleringsprinciper
Nyckelenzymer: glykogenfosforylas (nedbrytning) och glykogensyntas (uppbyggnad).
Reglering sker via:
- allosteri (energinivåer i cellen)
- reversibel fosforylering styrd av hormoner
- Ca²⁺-beroende aktivering vid muskelarbete
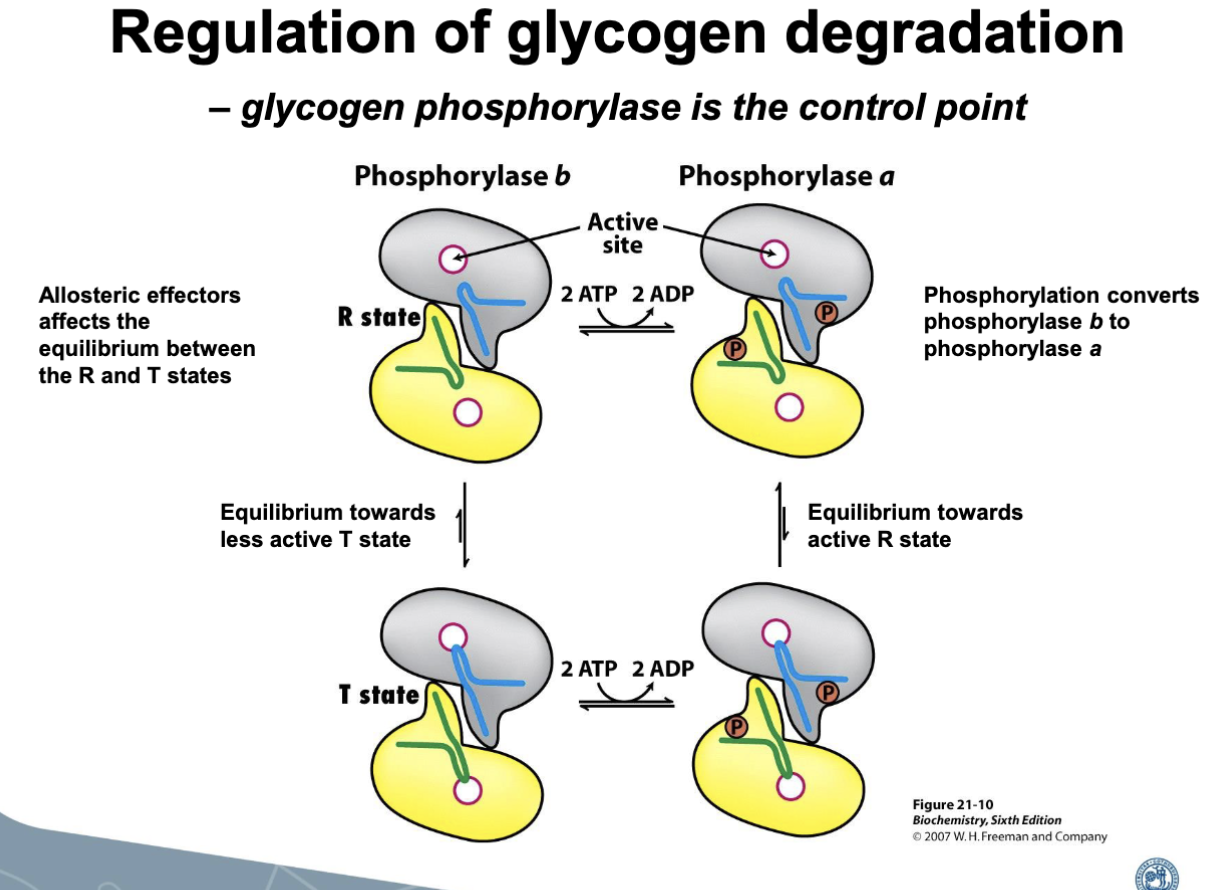
Glykogenfosforylas växlar mellan två konformationer:
- R-state (a-formen): aktiv, stabiliseras av fosforylering.
- T-state (b-formen): mindre aktiv, stabiliseras av defosforylering och vissa ligander.
Lever vs. muskel
- Levern prioriterar blodglukos. Glukagon aktiverar fosforylas. När glukosnivån stiger binder glukos allosteriskt och gynnar T-state → nedbrytning stoppas.
- Muskeln använder glykogen för egen ATP-produktion och reagerar inte på glukosnivåer. AMP (lågt energiläge) aktiverar fosforylas, medan högt ATP och/eller glukos-6-fosfat hämmar.
Reglering av glykogensyntas
- Den defosforylerade formen är mest aktiv (motsatsen till fosforylaset).
- Minst tre fosforyleringsställen bidrar till finjustering; flera kinaser deltar (PKA, GSK3 m.fl.).
- Glukos-6-fosfat är en stark allosterisk aktivator och speglar cellens glukostillgång.

Hormoner
- Insulin: frisätts från pankreas β-celler vid högt blodglukos, stimulerar glykogensyntes och defosforylering via fosfataser.
- Glukagon: frisätts från α-celler vid lågt blodglukos, verkar främst på levern och stimulerar glykogenolys + glukoneogenes.
- Adrenalin (epinefrin): produceras i binjuremärgen från tyrosin, förbereder muskler för akut arbete genom att mobilisera glykogen.
Hormonella signalvägar
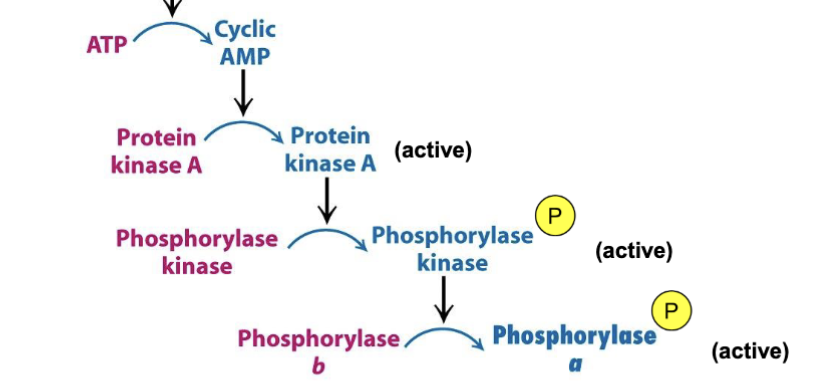
- Hormon (glukagon/adrenalin) binder receptor.
- Adenylatcyklas höjer [cAMP].
- Protein kinas A (PKA) aktiveras och fosforylerar nedströms mål.
- Fosforylaskinas aktiveras och omvandlar glykogenfosforylas b → a.
Fosforylaskinas och Ca²⁺
- Har katalytiska och reglerande subenheter (calmodulin-lika enheter binder Ca²⁺).
- Ca²⁺ från muskelsammandragning kan delvis aktivera fosforylaskinas även utan hormon, vilket kopplar muskelarbete till glykogenolys.
Proteinfosfatas 1 (PP1)
- Tar bort fosfatgrupper från glykogenfosforylas, fosforylaskinas och glykogensyntas.
- Insulin aktiverar PP1 → stoppar nedbrytning och stimulerar syntes.
- Glukagon och adrenalin hämmar PP1 via PKA-medierade mekanismer → bibehåller fosforylerade (aktiva) nedbrytningsenzymer.
GSK3 och insulin
- GSK3 (glykogensyntaskinas) fosforylerar glykogensyntas och gör det mindre aktivt.
- Insulinaktiverad PKB/Akt fosforylerar och hämmar GSK3 samt stimulerar PP1.
- Resultatet blir defosforylerat (aktivt) glykogensyntas och defosforylerat (inaktivt) glykogenfosforylas.
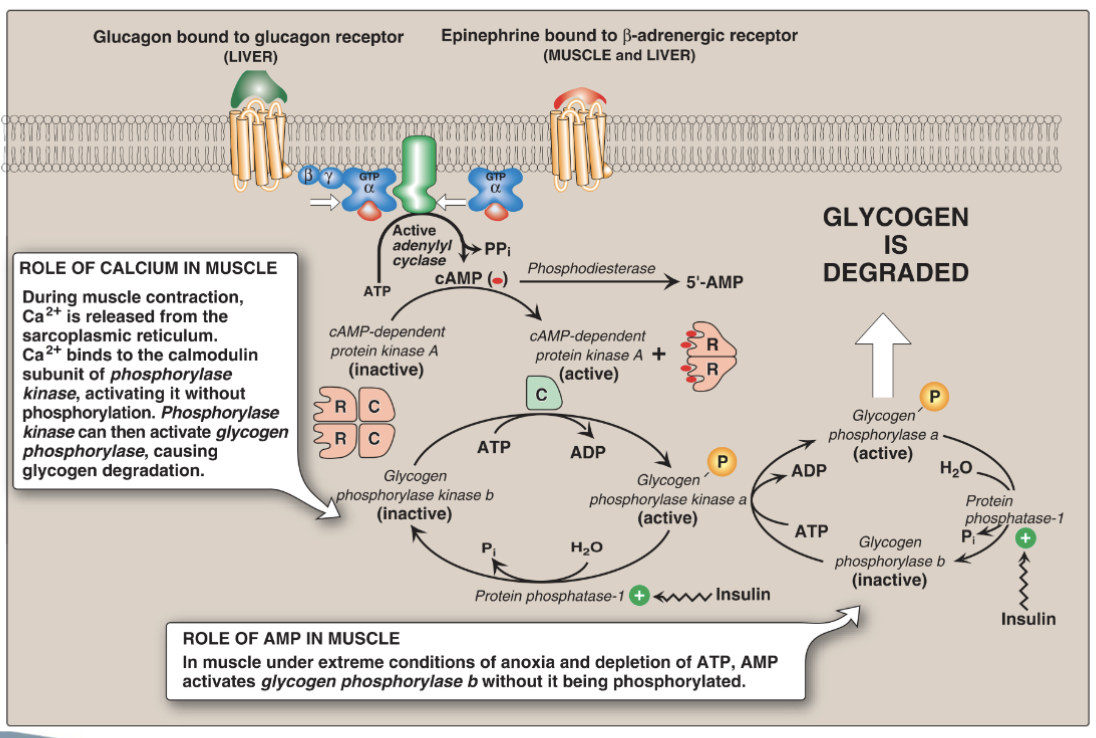

Glukagons primära målorgan är levern, medan adrenalin framför allt riktar sig till muskler.
Sammanfattning
Glykogenolys – viktiga enzymer
- Glykogenfosforylas
- Debranching-enzym (transferas + 𝛼-1,6-glukosidas)
- Fosfoglukomutas
- Glukos-6-fosfatas
- Protein kinas A
- Fosforylaskinas
- Proteinfosfatas 1
Glykogensyntes – viktiga enzymer
- Hexokinas/Glukokinas
- Fosfoglukomutas
- UDP-glukospyrofosforylas + oorganiskt pyrofosfatas
- Glykogenin
- Glykogensyntas
- Branching-enzym
- Protein kinas A
- Glykogensyntaskinas (GSK3)