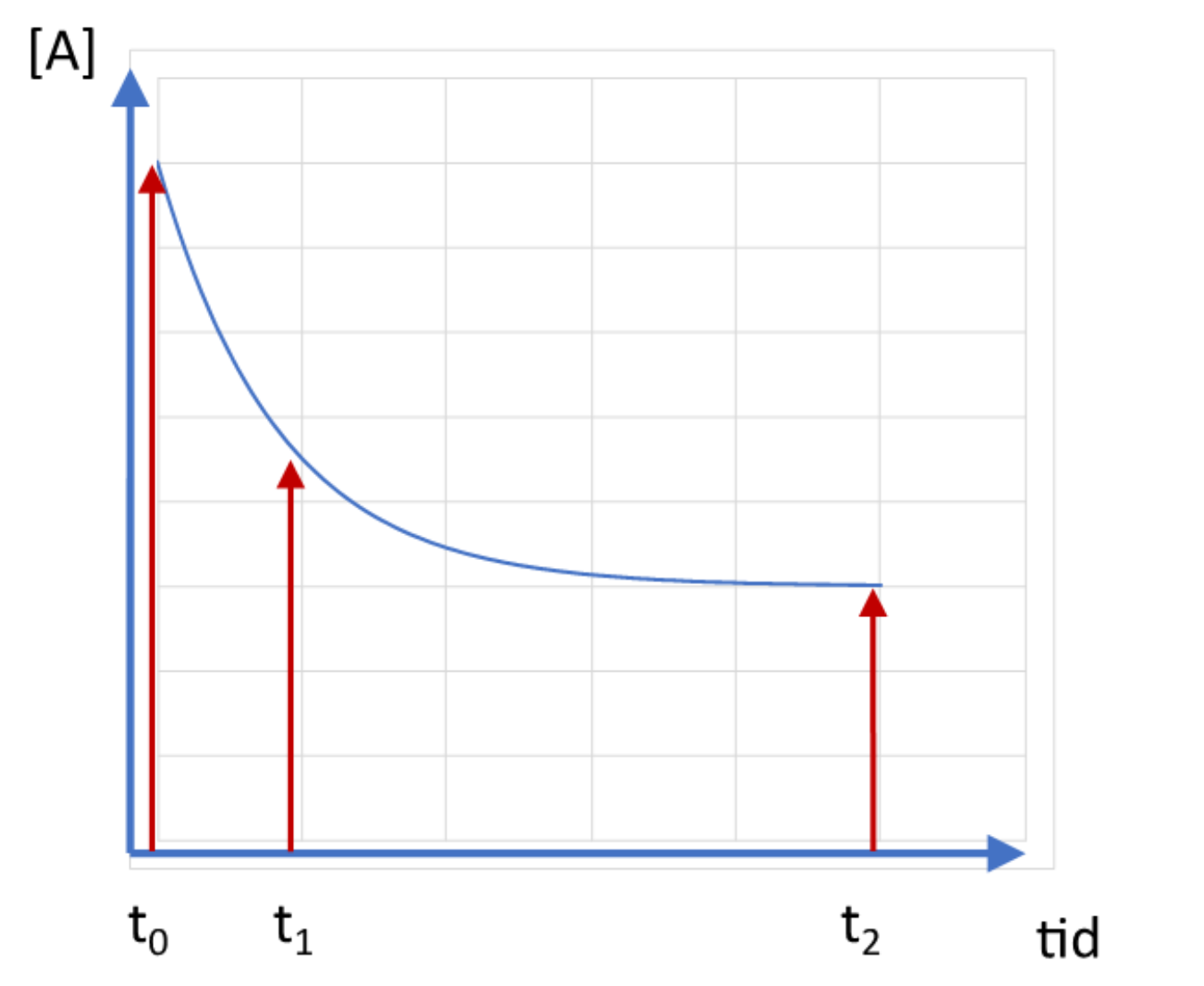
 Diagrammet ovan visar koncentrationen av ämnet A som funktion av tiden i en reaktion där A
omvandlas till ämnet B i närvaro av en låg koncentration av ett enzym som katalyserar
reaktionen. Enzymet tillsattes omedelbart efter tiden t0
Vi upprepar nu försöket på samma sätt, men med den skillnaden att vi nu tillsätter 10 gånger
högre koncentration av enzymet omedelbart efter tiden t0. Ange för var och en av tidpunkterna t0 t1 och t2 om [A] kommer att vara högre, lägre eller oförändrad jämfört med i diagrammet ovan. Ange också en motivation till ditt svar vid varje tidpunkt. (Max 150 ord.)
Diagrammet ovan visar koncentrationen av ämnet A som funktion av tiden i en reaktion där A
omvandlas till ämnet B i närvaro av en låg koncentration av ett enzym som katalyserar
reaktionen. Enzymet tillsattes omedelbart efter tiden t0
Vi upprepar nu försöket på samma sätt, men med den skillnaden att vi nu tillsätter 10 gånger
högre koncentration av enzymet omedelbart efter tiden t0. Ange för var och en av tidpunkterna t0 t1 och t2 om [A] kommer att vara högre, lägre eller oförändrad jämfört med i diagrammet ovan. Ange också en motivation till ditt svar vid varje tidpunkt. (Max 150 ord.)
Ge ett exempel på och förklara mekanismen bakom en förändring i metabolismen som sker vid högintensivt muskelarbete för att vi ska bli bättre på att utföra anaerob glykolys framöver. (Max 120 ord.)
För ett enzym är Michaelis-Mentens konstant (K ) 15 mM. Vid en substratkoncentration på 5 M mM, vad är förhållandet mellan reaktionshastigheten V och den maximala reaktionshastigheten V ? Motivera ditt svar. (Max 150 ord) (2p)
I en av delreaktionerna som katalyseras av chymotrypsin krävs närvaro av vatten, medan i en annan delreaktion krävs det att inget vatten är närvarande. Vilka är dessa delreaktioner och varför krävs närvaro respektive frånvaro av vatten i de respektive stegen? (Max 150 ord) (2p)
Hexokinas är ett enzym som kan använda både D-glukos och D-fruktos som substrat. Km för D-glukos = 0.05 mM är, och för D-fruktos = 1.5 mM. Vmax är detsamma för båda substraten. Vid samtidig tillsats av 1 mM av båda substraten till enzymet kommer produkter att bildas. Vilket substrat kommer att förbrukas först? Motivera svaret. (2p)
Vilka två av nedanstående påståenden om övergångstillståndet vid en enzym-katalyserad reaktion stämmer?
- Det ändrar enzymets optimala pH.
- Det tillåter reaktioner att fortgå vid en acceptabel temperatur.
- Det tillåter kemikalier att reagera som annars inte skulle göra det.
- Det tillåter reaktioner att fortskrida snabbare.
Vilka påståenden om övergångstillståndet för en enzym-katalyserad reaktion stämmer?
- Det har högre energi än för en icke-katalyserad reaktion.
- Det har lägre energi än reaktionens substrat.
- Det är mycket kortvarigt.
- Det har lägre energi än för en icke-katalyserad reaktion.
Ett enzym uppvisar Michaelis-Mentens kinetik. A) Hur kan man i ett V mot [S] diagram avläsa de två konstanterna Km och Vmax? B) Förklara vad som händer med Km respektive Vmax om man tillsätter en kompetitiv hämmare. (2p)
Vilka två av nedanstående behöver du känna till för att beräkna omsättningstalet för ett enzym? (1p)
- Enzymstrukturen.
- Enzymkoncentrationen.
- Initialhastigheten för den katalyserade reaktionen vid [S] >> Km.
- Km för substratet.
Två fördelar med att mäta den initiala hastigheten för en reaktion, V , är att i början av en reaktion… (2p)
- har variationer av [S] inte någon effekt på V0.
- kan produktinhibering inte påverka hastigheten.
- är förändringar i Km försumbara, så Km kan behandlas som en konstant.
- är förändringar i [S] försumbara, så [S] kan behandlas som en konstant.
Vad är syftet med den katalytiska klyftan som finns i ett enzym? Redogör för två fördelar den katalytiska klyftan ger för katalys. (4p)
Hexokinas är ett enzym som kan använda både D-glukos och D-fruktos som substrat. Km för D-glukos = 0.04 mM är, och för D-fruktos = 1.7 mM. Vmax är detsamma för båda substraten. Vid samtidig tillsats av 1 mM av båda substraten till enzymet kommer produkter att bildas. Vilket substrat kommer att förbrukas först? Motivera svaret. (4p)
Vilka två påståenden om kompetitiva hämmare är korrekta? (2p)
- De binder reversibelt till det aktiva stället.
- De binder till flera olika ställen på ett enzym.
- De sänker reaktionens karakteristiska Km.
- De binder kovalent till enzymet.
Ett enzym uppvisar Michaelis-Mentens kinetik. A) Redogör för hur man i ett V mot [S] diagram kan avläsa de två konstanterna Km och Vmax. B) Förklara vad som händer med Km respektive Vmax om man tillsätter en icke-kompetitiv hämmare? (4p) (Max 150 ord.)
Om ∆G°´ för reaktionen A → B är -40kJ/mol under standardförhållanden så… Välj de två korrekta alternativen nedan. (2p)
- är den långt ifrån jämvikt.
- kommer den att gå från vänster till höger spontant.
- kommer den att fortsätta i snabb takt.
- kommer den aldrig att nå jämvikt.
Enzymet A som omvandlar S till P har ett Km på 10 µM och ett Vmax på 100 nmol/s. Enzymet B som omvandlar S till Q har ett Km på 1 mM och ett Vmax på 200 nmol/s. Lika mängder av A och B blandas med 100 µM S i ett och samma kärl. Vad kommer man att ha mest av när reaktionerna är klara - P eller Q? Motivera ditt svar. (4p) (Max 150 ord.)
Vilka två av nedanstående påståenden om enzymer är korrekta? (2p)
- Enzymer förändrar den fria energin i en reaktion.
- Enzymernas tredimensionella form är nyckeln till deras funktion.
- Enzymer påskyndar reaktioner genom att sänka aktiveringsenergin.
- Enzymer är alltid proteiner.
Ett enzym uppvisar Michaelis-Menten kinetik, vilket gör det möjligt att bestämma dess Km- värde. Km kan man använda för att förstå:
- Hur snabbt det går för bundet substrat att bli omsatt till frisatt produkt.
- Hur sannolikt det är att substrat binder till enzymet.
- Hur bra ett enzym kan skilja mellan olika möjliga substrat.
- Hur sannolikt det är att substrat lossnar från enzymet när det har bundit.
Fördelen med att mäta den initiala hastigheten V 0 i början av en reaktion är att (välj två av nedanstående): (2p)
- Förändringar i [S] är försumbara, så [S] kan behandlas som en konstant.
- Produktinhibering kan då inte påverka hastigheten.
- Förändringar i Km är försumbara, så Km kan behandlas som en konstant.
- Variationer av [S] har ingen effekt på V0.
Enzymer har ofta en katalytisk klyfta där den katalyserade reaktionen sker. Redogör för två olika kemiska fördelar med detta. (4p)