Vad bestämmer reaktionshastigheten
- temperatur
- tryck
- reaktionens natur
- koncentration av reaktanterna
- lösningsmedel etc ej viktig för denna föreläsning
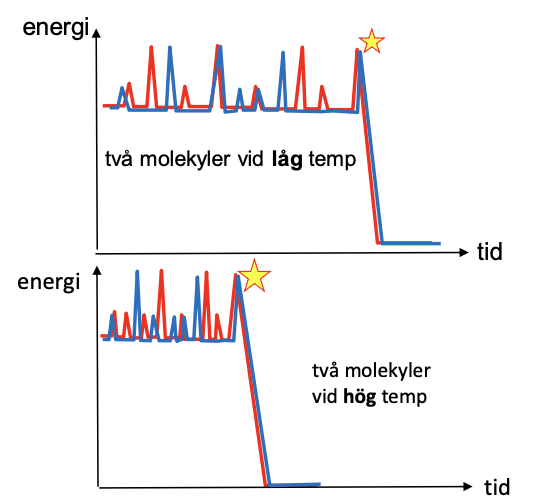
En ökning av temperaturen minskar kinesiska energin som behövs för att utföra reaktionen (reaktantmolekylerna)
- det höjer sannolikheten att molekylerna krockar med varandra eftersom det krävs mindre energi för att det ska ske
Aktiveringsenergin är skillnaden mellan övergångstillståndet och reaktanterna (T - R)
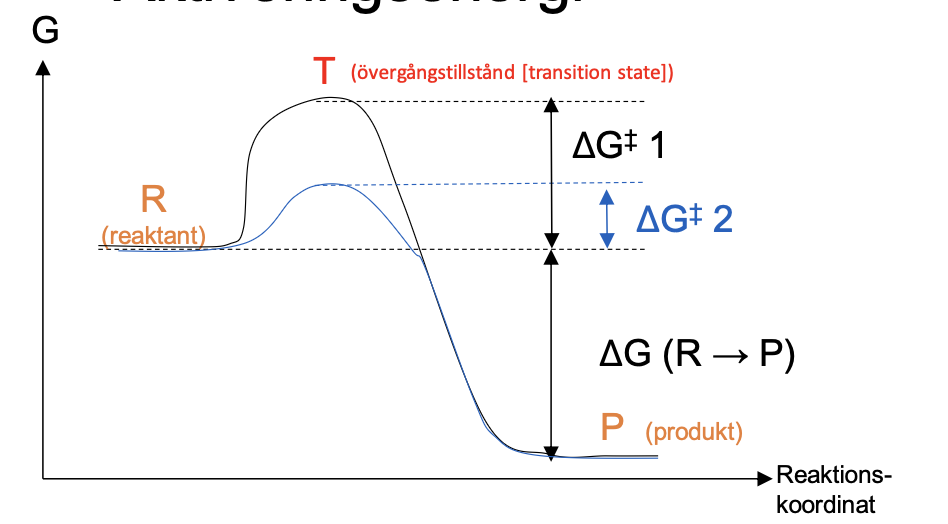 Nettoreaktioenn P - R är alltid det samma, oavsett aktiveringsenergi.
Aktiveringsenergin kan sänkas med en katalysator som en enzym.
Nettoreaktioenn P - R är alltid det samma, oavsett aktiveringsenergi.
Aktiveringsenergin kan sänkas med en katalysator som en enzym.
Ej reaktion utan katalysator kostar mer, kräver mer energi
Katalysatorn gör att det går fortare
Katalysatorn binder in reaktanterna i rätt konfiguration, förlänger/stabiliserar övergångstillståndet
Enzymer
Vanligaste katalysatorerna i kroppen är enzymer gjorda av proteiner, men det finns ett par stycken som är RNA.
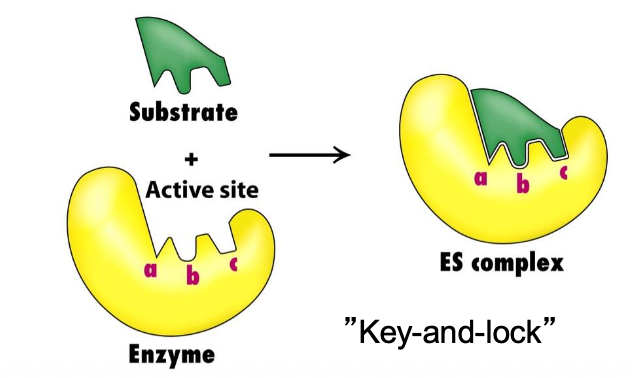
Aktiva ytan av enzymen måste passa formen på produkten. Enzymet tvingar någonting som liknar övergångstillståndet som förenklar övergångstillståndet
Enzymet kan antingen
- stabilisera TS (övergångstillstånd)
- erbjuda alternativ reaktionsväg TS
aktiv site / klyfta / trång inbuktning
- specificitet för substrat
- miljö som förenklar reaktionen
- utesluter vatten
enzymer är unika för att de kan välja substrat med hög specificitet
ett slags nyckelhål
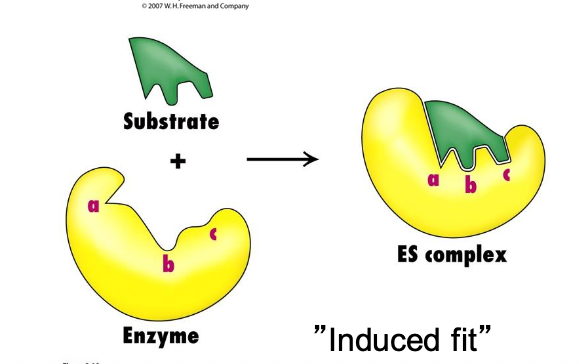
Finns också enzymer som byter form för att substratet ska passa
I en klyfta/aktivt centrum finns det speciella kemiska miljöer som t.ex. deprotonerad serin som är mycket hydrofob vilket gör att vatten kan uteslutas så vi bara får de substrat vi vill
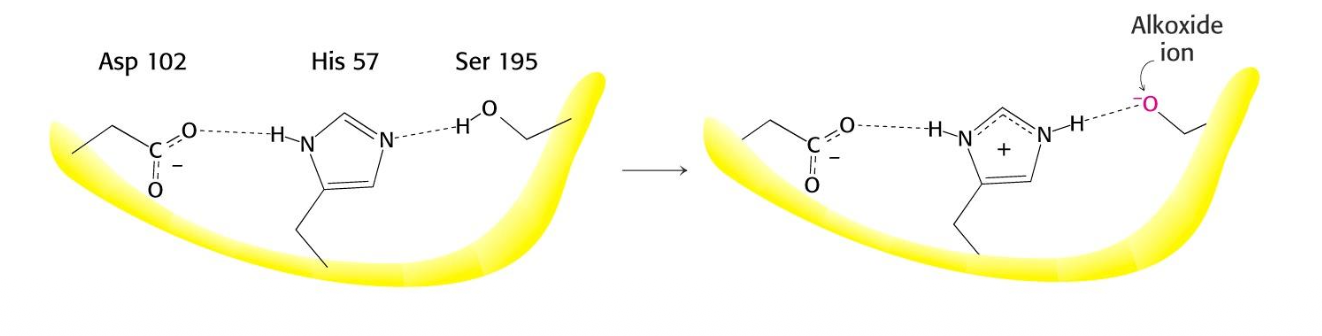 reaktioner i ett enzym sker på en liten del, men proteinerna är ofta stora, det är för att stabilisera en sådan klyfta och säkerställa och en viss form kan skapa, tillräckligt med massa runt omkring för att klyftan ska vara stabil.
reaktioner i ett enzym sker på en liten del, men proteinerna är ofta stora, det är för att stabilisera en sådan klyfta och säkerställa och en viss form kan skapa, tillräckligt med massa runt omkring för att klyftan ska vara stabil.
- Aktiva centret kan vara uppbyggt av aminosyrasekvenser väldigt lång ifrån varandra på grund av veckning
- allesteriska receptorer har sina egna siter
- finns speciella substratkanaler
Allosteri - enzymet påverkas av något som händer någon annanstans
- inhibitorer, nu har vi tillverkat tillräckligt med produkt
- aktivering, man ändrar strukturen på enzymet med hjälp av t.ex. fosforylering
- kooperativit - enzymet ökar om det finns mer produkter
co-faktor: nödvändigt bihang som inte är protein apoenzym: proteindelen av enzymet holoenzym: apoenzym + co-faktor cozenum: co-faktor som är organisk molekyl prostetisk grupp: co-enzym hårt bundet till apoenzym
vitaminer metaboliseras till co-enzymer
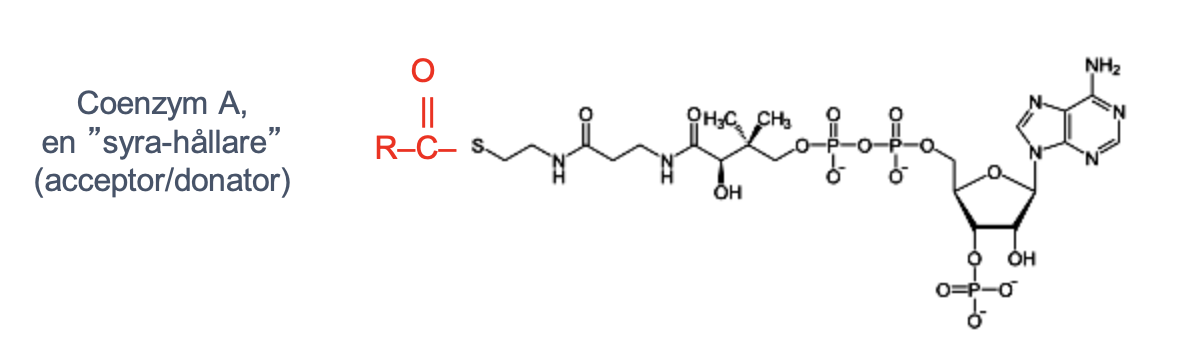
 Coenzymer kan flytta intermediärer mellan subenheter/polypeptidkedjor i enzymproteinkomplexet → ett enzym kan ha flera aktiva centrum
Coenzymer kan flytta intermediärer mellan subenheter/polypeptidkedjor i enzymproteinkomplexet → ett enzym kan ha flera aktiva centrum