Organeller
- kärnan
- informationslagrning
- replication
- transkription
- Nukleol - ribosomsammansättning
- ER
- släta: lipidsyntes
- sträva: ribosomer och translation
- Golgi
- glykosylering
- sekretion
- Mitokondriet - primära metabola organell
- metabolism
- mest nerbrytning, mål är ATP-produktionen
- Peroxysomer
- lite metabolism
- Lysosomer
- nedbrytning
- Plasmamembranet
- skydd
- signalering
- igenkänning
- upptag
- centriol
- utgångspunkt för mikrotuber
- cellcykel
- cytoplasman
- allt som är organller
- signalering
- metabolism
- energilagring
- ribosomer
- translation
Gå igenom nästan alla dessa processer under kursen!
Cellens energibehov
- uppbyggnad av makromolekyler (RNA, DNA, proteiner)
- gradienter - aktiv transport, signalering
- rörelse - muskelkontraktion, migration
- värme - hålla temperaturen
- för att hålla ordning behövs mer oordning på annat håll
- oordning → jämnvikt → död
- funktion kräver ordning
Livets molekyler
Nukleinsyror
- information och dess överföring
- DNA → RNA
- 5 nukleotider
- translation Protein
- struktur
- signalering
- enzymer
- transport
- igenkänning (receptorer)
- immunförsvar
- 20 aa Kolhydrater
- glykosylering
- energilagring (glykogen)
- ett tiotal Lipider
- membran
- energilagring
- tusental (variationer av huvud) Främst COHN
- ofullständiga yttre eletronskal
- vill dela é → kemisk bindning
Kovalenta bindingar
Delning av elektronpar
- enkelbindning, fri rotation, 85kcal/mol, ~1.54Å
- dubbelbindning plan struktur, rotation ej möjlig, 150kcal/mol, ~1.34Å
Resonansstabilisering
Fördelning av é över flera atomer
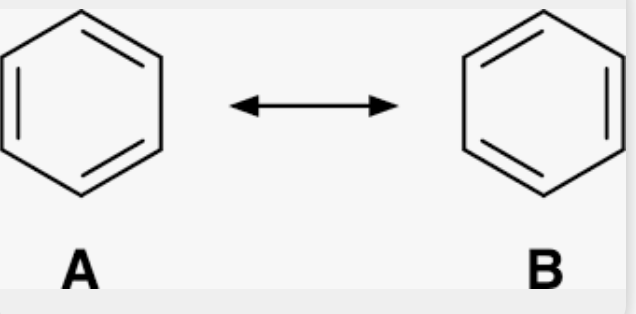
Plan binding ~1.4Å släta lipidsynetes sträva translation
Jonbindning
F = den elektrostatiska kraften mellan jonerna där
- k = Coulombs konstant (≈ 8,99 × 10⁹ N·m²/C²)
- , = jonerna laddningar
- r = avståndet mellan jonerna
- = materialets dielektricitetskonstant (relativa permitivitet)
- ju mer joner, ju mer polär, vatten har högst
- vatten används som lösningsmedel i våra celler
- högst
- svaga jonbindingar, för vatten ska orientera sig runt jonerna
- 1-5kcal/mol
- hexan
- = 2
- jonbildningarna i hexan blir 40ggr starkare än i vatten
- ankikort hur man 1.4 kcal/mol för envärda joner
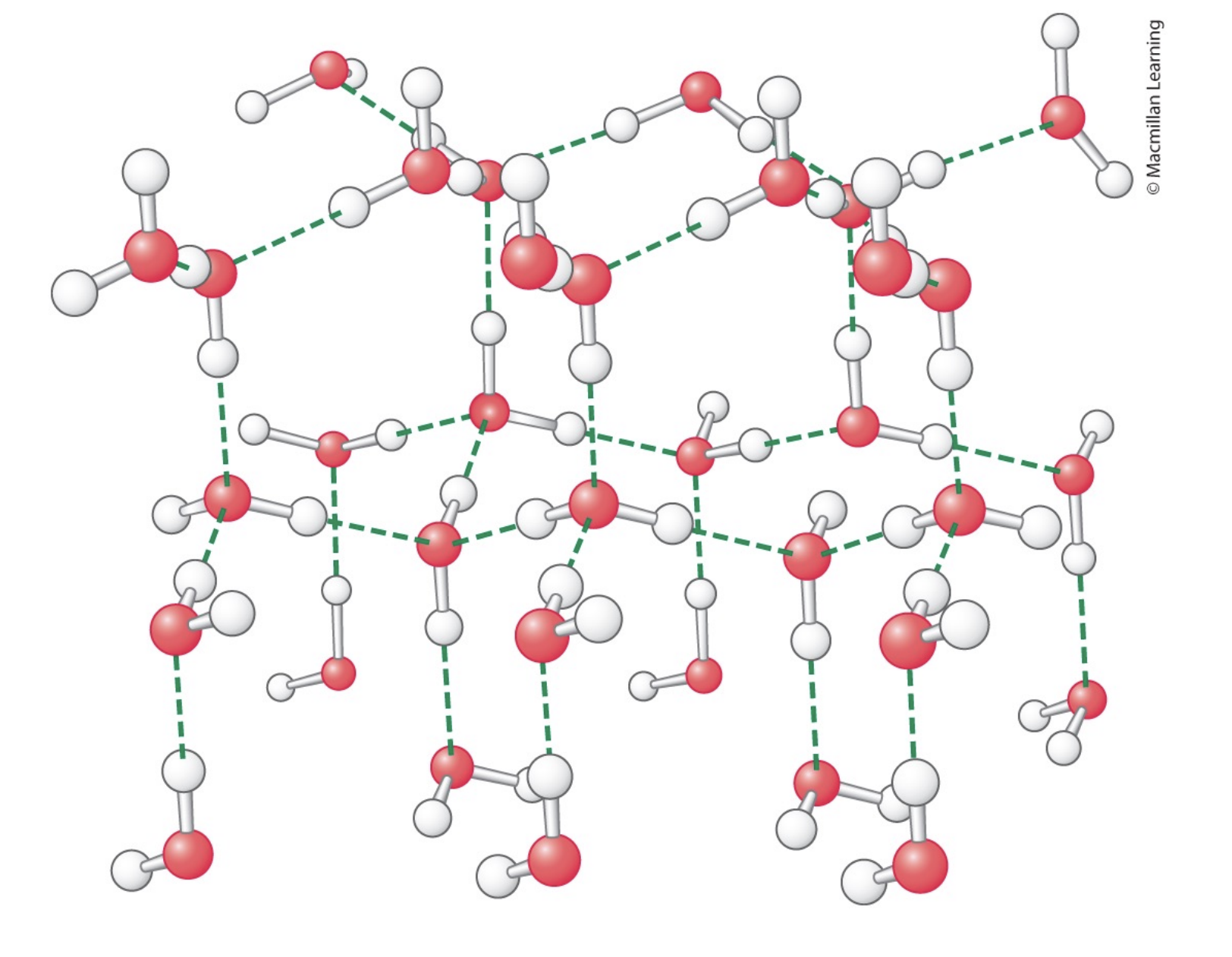
Vatten
Syre har högre elektronegativ än väte δ-/δ+ Elektronegativitet, dragningskraft för elektroner
- F - ovanligt
- O - om det är med vinner det
- N
- Cl - ovanligt
- Br
- I
- S
- C
- H - väte kommer alltid förlora i en binding/molekyl
Fonclbrisch
Hydratiseringsskal runt. Vatten bildar ett nätverk mellan δ-/δ+
Vätebindning
Bildas mellan dipoler
- Donator: grupp där vätet är δ+
- Acceptor: δ- och ha ett fritt elektronpar I celler oftas & som donator/acceptor Ju rakare, desto starkare,
van der waals-bindingar
é runt atomer flukturerar → tillfällig dipol bara när två molekyler är riktigt nära varandra ~3.6Å optimalt om närmare repulsion 1-5 kcal/mol per atompar & mol
hydrofob effekt
- hydrofob: lipider, opolära
- hydrofil: kolhydrater, aa, polära
hydrofoba molekyler aggregerar (klumpar ihop sig) i vatten vatten bildar burar runt hydrofoba föreningar aggregering - förre H2O i burar
DNA dubbelsträngbildning av DNA
I vatten(celler) bildar komplementära DNA-strängar en dubbelhelix. komplementära: A=T C≡G - vätebindingar Observation: det kan ju binda sig i vatten, så vi får ingen nettovinst genom att para ihop dom. I vatten vätebindingar mellan baser gör att den rätta parningen kräver minst energi Varken nettovinst eller förlust av vätebindningar vid korrekt basparning → den blir rätt Drivkraft: separation av laddningar (Pi) kommer hamn så lång ifrån varandra som möjligt, dessutom har vi vatten som avskärmar dom i celler har vi också joner som hjäper till Mg2+ Na2+ baser plana, staplas i mitten av strängen, kommer på ett av stång av 3.4Å
- då får vi van der waals interaktion mellan baserna
- delar av baserna är hydrofoba, när de är med i vätebindingarna interaktioner med andra, göms från , vända innåt I oparat DNA bildas vätebindingarna mellan baserna och
pH
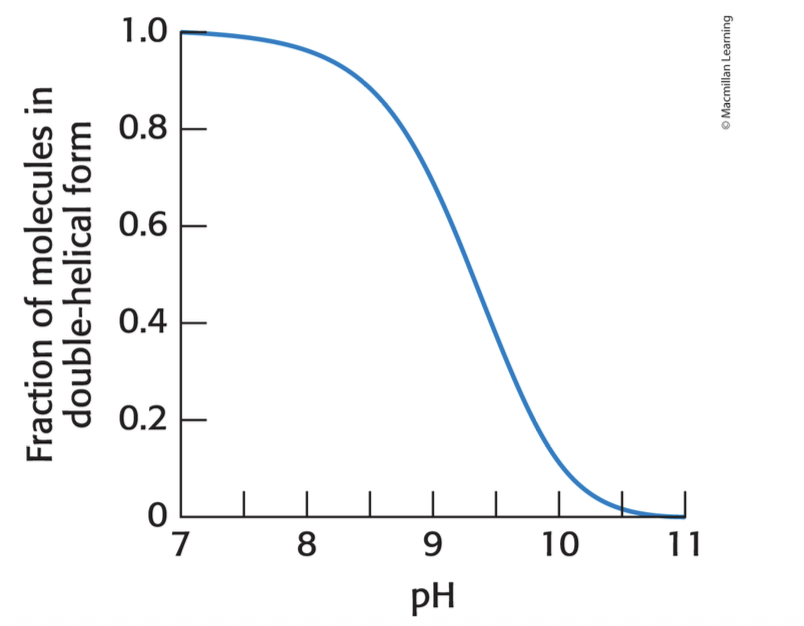 Det finns ingen vätebindingsförmåga kvar vid pH 11 och de släpper ifrån sin väteproton och blir en negativ jon. Utan vätejon
Det finns ingen vätebindingsförmåga kvar vid pH 11 och de släpper ifrån sin väteproton och blir en negativ jon. Utan vätejon
Jämnviktskonstant, förklarar via Henders-Hasserbalch ekvation Vad händer när det finns lika mycket bas som syra i det här systemet? När [A-] = [Ha-] - log(1) = 0
Vid buffrande förmåga Det finns antingen en bas eller syra som kan ta upp/lämna en proton. En rad molekyler som gör att det krävs mycket för att göra en pH förändring
nukleotider bildar spontana xxx bindingar, fosfat grupper separas så mkt som de negativa bindningar,