Will not be looking into the grammar at the examination, just the context you can mix swedish
Oxygen transporting Binding in lungs and carrying it into where it is needed Present in RBC
- 5 liters of blood
- RBC
- hemoglobin per RBC
- No need to know
Lärandemål
- beroende av
- proteinstrukturen
- bindningspartnern
- enskilda aminosyrors egenskaper
Molecular recognition
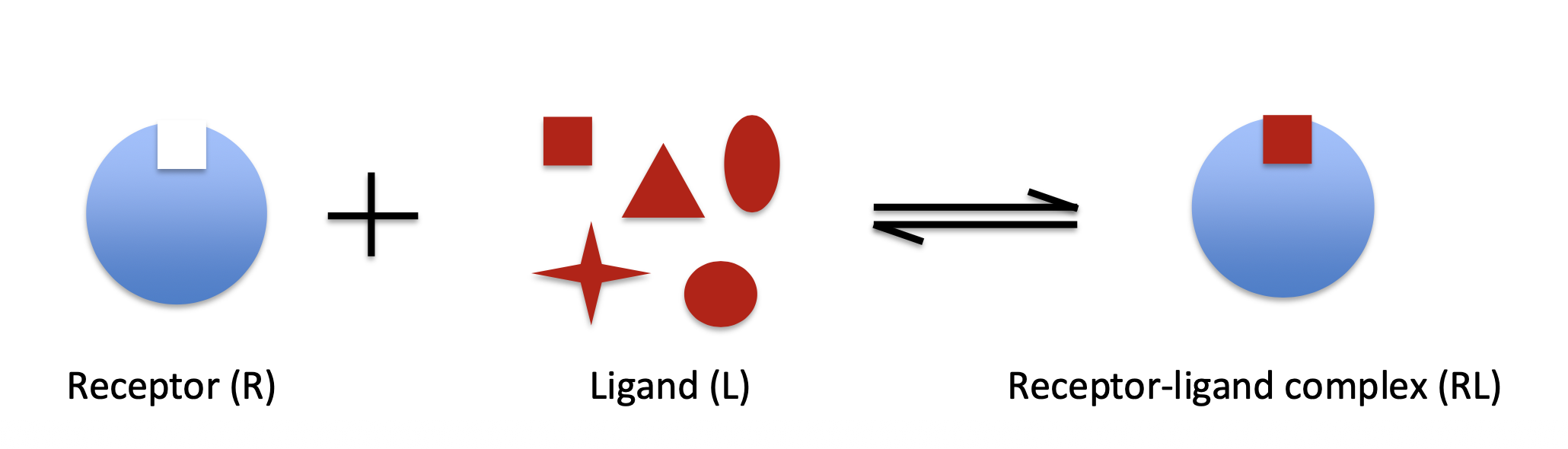
- Receptor + Ligand = Receptor-Ligand Complex
- Note this is an equilibrium
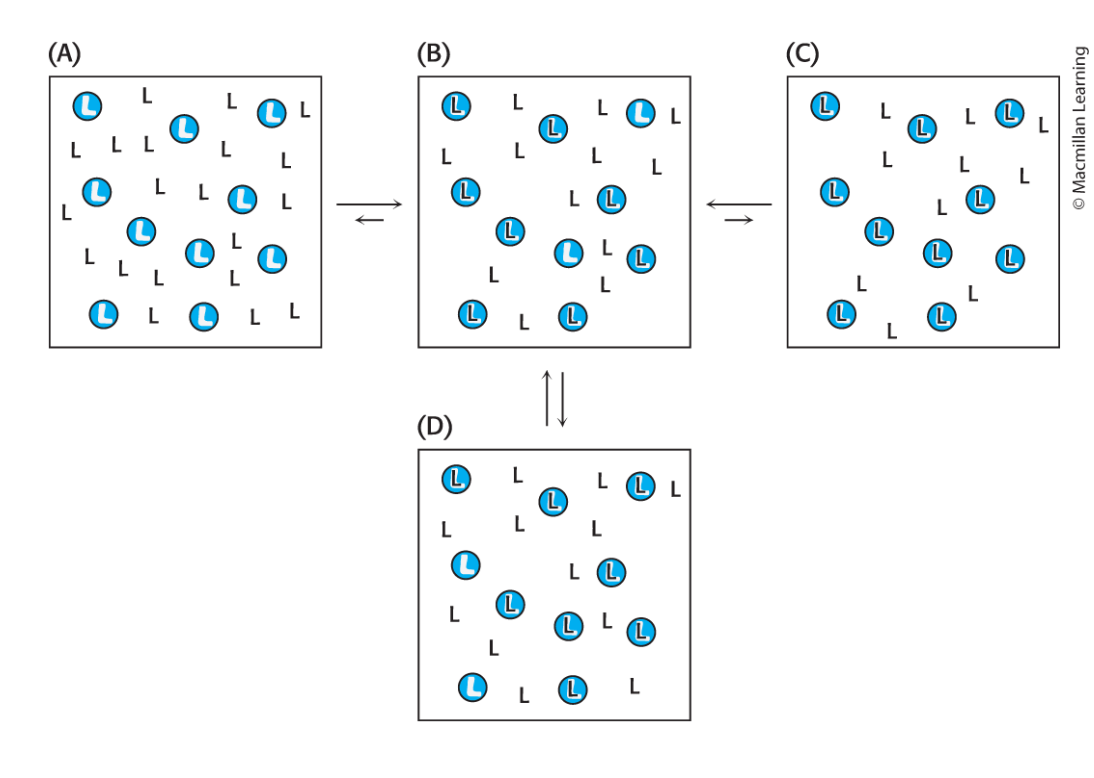
-
konstig slide färger säger om L är bundet till en Blå rund receptor
-
the total number of complex molecules receptor/ligands are equal in B and D
- the concentrations of all species are constant.
- the dissociation and association rates must balance
-
hemoglobin is a receptor, oxygen is a ligand
-
bindningsaffinitet, binding affinity, hur starkt syre binder till hemoglobin
-
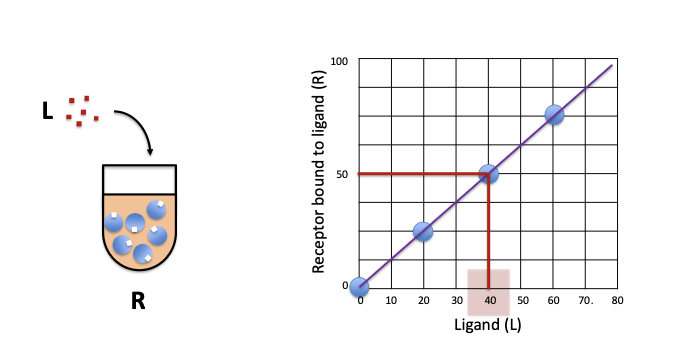
- Y axis is %
- = koncentrationen där hälften av alla receptorer är bundna till liganden
- = 40 i bilden ovanför, X-axel
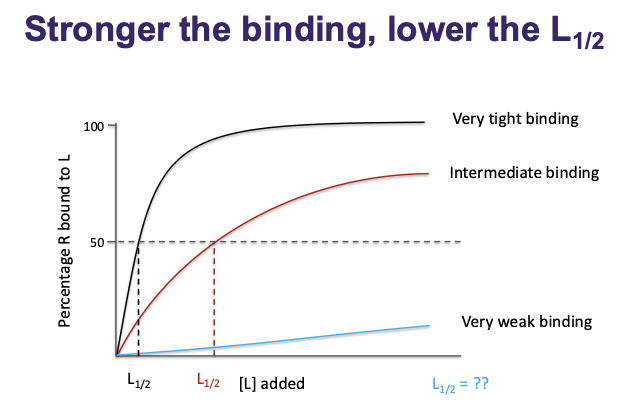
-
Ju starkare ligand ju mindre behöver vi för att binda med en receptor, om det är en svag behöver man väldigt många ligande för att kunna binda.
Bindningsfickan av en molekyl är specifik för ett visst ligand, de har olika former så det passar i varandra.
Det kan vara väldigt små skillnader, t.ex. det kan räcka med att vinklarna på olika atomer sitter annorlunda.
nM = nano mol enhet för att mäta ligander
Myoglobin
Enklare än hemoglobin, bara en subenhet. Finns mycket, 0.5% av totala vikten i kroppen i muskler. Prostetisk grupp heme, där syret binder för att kunna transporteras i kroppen.
- Prostetisk = som inte är baserat på aminosyror
Heme
fyra stycken pyrrole ringar som är bundna till en järnatom. järnatomen kan ha 6 bindningar:
- en med varje pyrrole ring
- femte med den proximala histine aminosyran
- histsidine hjälp till att hålla järnatomen på plats
- sjätte med själva syremolekylen
- VIKTIGT: syreatomen flyttar positionen på järn i heme när den binder
Järn och syra kan finnas i två tillstånd
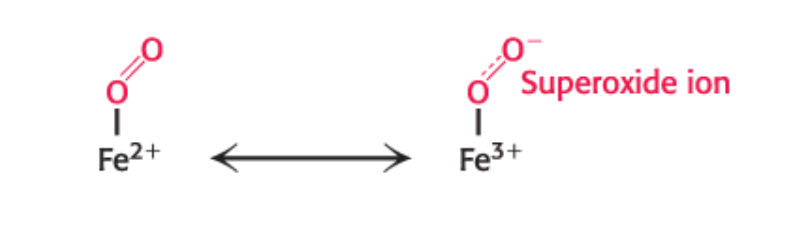 superoxidevarianten är farlig för våra celler, viktigt att inte ha den i våra kroppar. Distala histine hjälper till att hindra konverteringen till superoxide.
superoxidevarianten är farlig för våra celler, viktigt att inte ha den i våra kroppar. Distala histine hjälper till att hindra konverteringen till superoxide.
oxygen binding
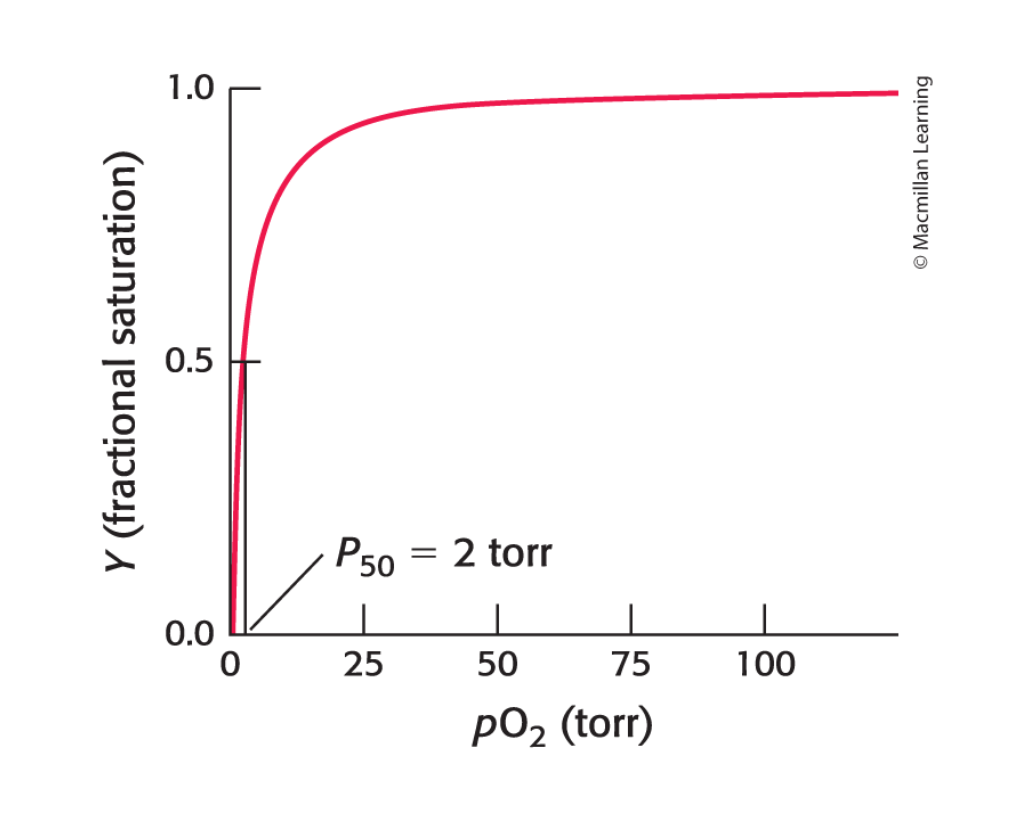 2 torr är extremt låg
är samma som
dvs, oxygen och myoglobin har extremt lätt att binda till varandra
2 torr är extremt låg
är samma som
dvs, oxygen och myoglobin har extremt lätt att binda till varandra
kolmonoxid konkurrerar med syre om samma plats
- CO bindningen är 100 gånger större än
- 100 gånger större bindingsaffinitet
distala histidin är involverad och sänker den, men trots det skulle det vara mer än 100ggr
Hemoglobin (Hb)
Större än myoglobin, den har fyra stycken subenheter. Varje subenheter har en egen hememolekyl som kan binda en syre. Heme i de olika subenheterna interagerar inte med varandra. Fungerar oberoende av varandra.
En Dimer är 𝛼-subenhet och β-subenhet
- En dimer kan också vara två dimers
- dimer är ett komplex av två subenheter
Själva bindningen av syre skapar strukturella skillnader i hemoglobin. Järn flyttar in i porfyrringen, proximala histidine och 𝛼-helix flyttar sig mot järnet.
Själva interfacet, det gula flyttar på sig och påverkar den ANDRA dimern.
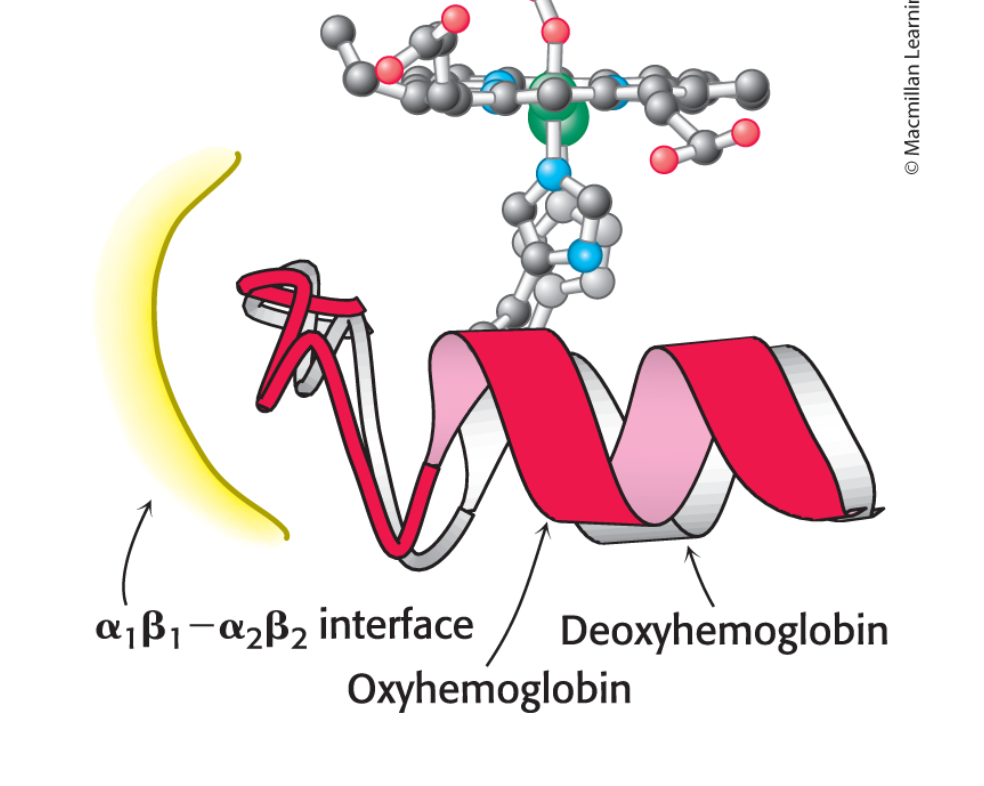
- T (tense) <→ deoxyhemoglobin
- R (relaxed) <→ oxyhemoglobin
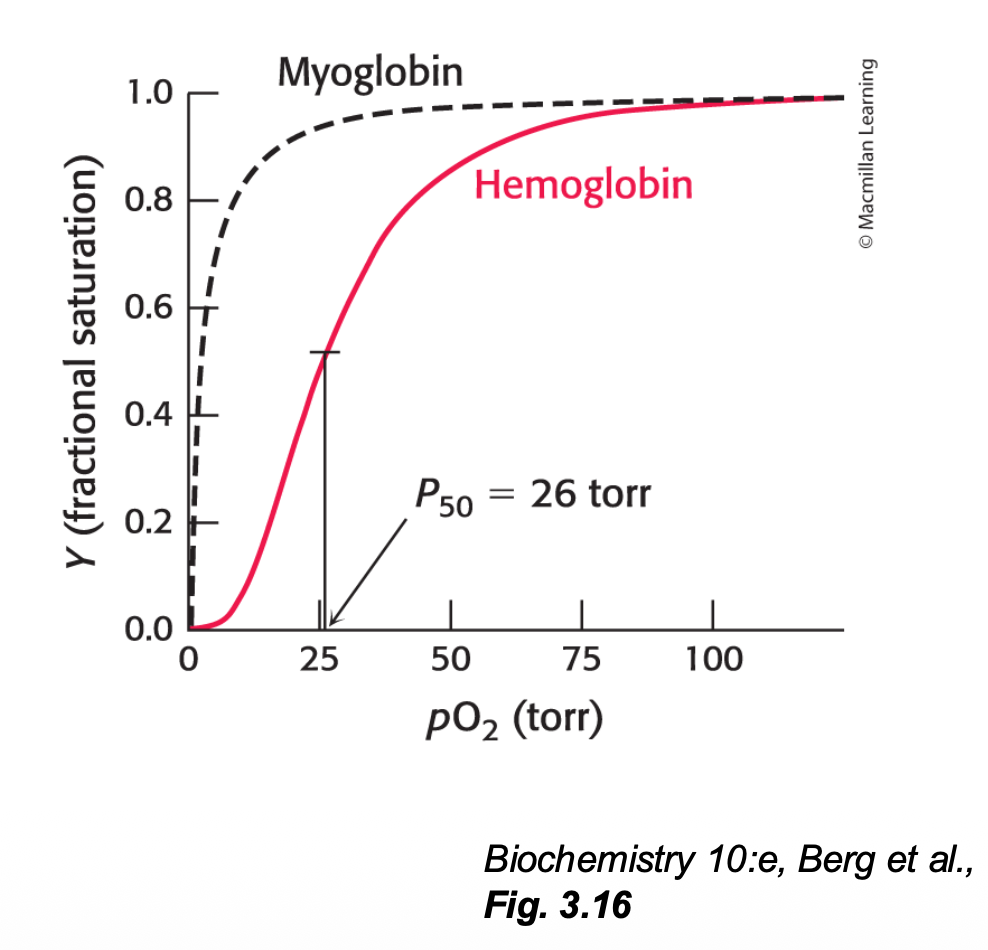 Hb är mer sigmoid S-kurva
Ladda:
Hb är mer sigmoid S-kurva
Ladda:
- När Hb har en bunden syremolekyl är det lättare att binda det andra 3. Släppa
- När Hb släpper en bunden syremolekyl är det lättare att släppa det andra 3.
= 26 torr dvs 13 ggr högre än för Myoglobin
one oxygen promotes the release/binding of the others. Det kallas kooperativt där de hjälper till, det är en unik egenskap av en hemoglobin (det tyckte föreläsaren var viktigt)
P = Partial pressure of Oxygen, how you measure oxygen in gases
Kooperativt:
- effektiv och komplett (alla 4) syretransport
- tar med det där det behövs mest
bara 7% av myoglobin skulle kunna släppa syre där det behövs
men 66% av hemoglobin släpper, så kooperativt gör det väldigt effektivt, skulle vara 38% om inte var kooperativt
7%/66% hur effektivt det kan transporteras
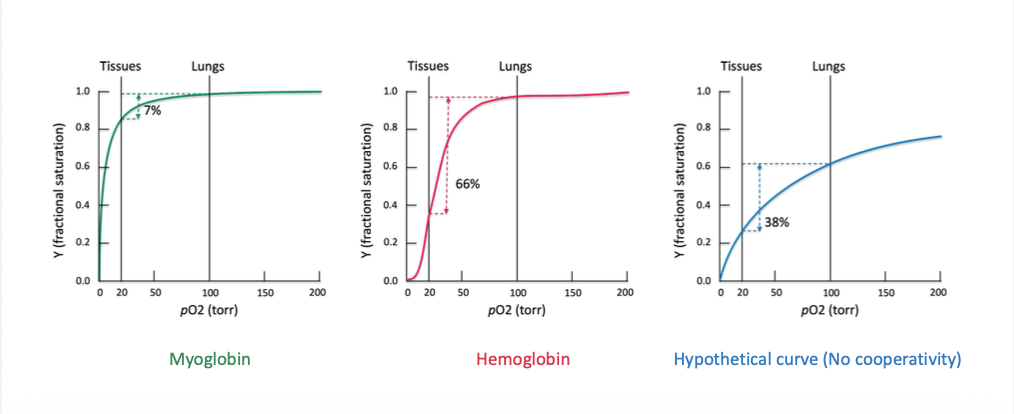
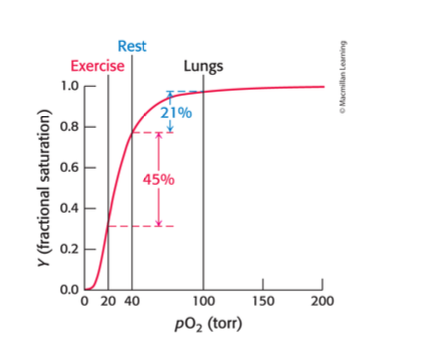 mer syre är transporterat där det behövs, 66% effektivitet i muskler som används och 21% när de vilar.
mer syre är transporterat där det behövs, 66% effektivitet i muskler som används och 21% när de vilar.
Concerted model
- finns bara T och R state, inga andra
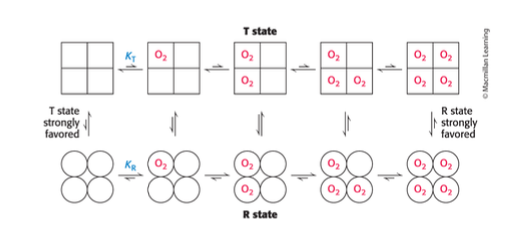
- T state when nothing is bound
- R state when it is bound
- what happens in between?
- this model says that when there is no oxygen bound the state is more/higher than this state and it wil lalways be in the state
- when there is one oxygen bound the likelyhood is still be in the T state higher than in the R state. there is also a likelyhood that it can be in the R state
- R state is strongly favoured when there is bindings
- i början följer det den teoretiska T-state kurvan sen binder lite syre och det följer R-state eller iaf parallelt
- begränsning det förklarar inte de strukturella ändringar som krävs av delvis syrebindning
Sequential model
- T state, R state and intermediate states
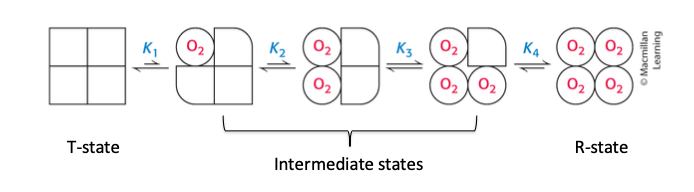
- formen ändras på hörnen, så småningom ändras alla
- intermediate structural states of Hb
- Limitations: HB finns främst i T-state när en subenhet binder too syre och R när 3 subenheter är bundna till syre
Allosteric regulation
Det finns en annan del av ett protein (Hb t.ex.) där den allosteriska regulation binder, det skiljer sig från den aktiva delen där syre binder. En competitor kan binda till samma ställe där liganden binder (CO, )
2,3-BPG binder till β-subenhetn på Hb i T-state stabiliserar T-state och förenklar syres frisläppning 2,3-BPG gör att att bindningen till syre försvagas och ökar effektivitet av transporten
HbF har andra subenheter, 2,3-BPG har lägre bindningsaffinitet. Det gör att syre kan transporteras från moderns HbF till fostrets HbF.
Andra allosteriska egenskaper av Bohreffekten är att vätejon och koldioxid kan binda till Hbmolekylen stabiliserar T-state och flyttar på dissocationkruvan
I muskeln finns det mer vätejoner och pH är lägre Syreskillnaden influenserar frisläppandet av syre från Hb Lägre pH gör att bindningsaffinitetav Hb minskar Vilket i sin tur förbättrar effektiviteten av frisläppandet av oxygen
binder till aminosyror i C-terminalen i 𝛼-subenheterna till Histidin
reagerar med vatten för att skapa bikarbonatjoner och vätejoner
- gör pH lägre och stabiliserar T-state kan också binda direkt till C-terminalen på aminosyrorana och skapa carbamatejon stabiliserar T-state coh frisläpper syre
Sicklecell
En genetisk mutation av Glu 6 byts ut till Val 6 Val 6 kan interagera med hydrofobiska kvarlämnor av en Hb-molekyl
- Kan skapa stora fibrösa / polymerer av aggregat
- Distraherar celler att skapa dessa sickleceller
- Sicklecellerna är stora och kan blockera blodkärl genom att sätta sig i väggarna
- SCD hittas mest hos vuxna
- Hb F alpha och beta kedjor
- Hb A har alpha och betakedjor
- Dyker upp efter 5-6 månader
- kan skapa anemi
- finns genterapi för SCD, ökad HbF-produktion