Sekundär struktur (fortsättning)
-flak
Plan utsträckt Uppbyggt av -strängar, måste ha minst två Strängar från olika delar av primärsekvensen
- Antiparallel, N- och C-terminaler i olika riktningar ➡️⬅️
- vätebindningar är starkare ju rakare de är
- vätebindningar är parvis
- Parallela, N- och C-terminaler i samma riktning ➡️➡️
- vätebindningar ej raka
- alla bindingar från olika aminosyror Prolin passar ej (ringa in alla aminosyror i bilden för att öva)
Loopar
Förbinder 𝛼-helixar och β-strängar Oordnad struktur - kan ordnas Vid interaktion med annat protein
Proteindomäner
Sekundärstrukturdomain som ordnas på specifikt sätt - funktionell 50-200 aminosyror
Tertiärstruktur
3D-struktur → protein Kan börja kotranslationellt (samtidigt som RNA translateras till en proteinsekvens) Stabiliseras av många olika bindingstyper
- vätebindningar mellan sidokedjorna (-R)
- hydrofob effekt
- van der Waals-krafter (speciellt aromatiska som ligger på rätt avstånd)
- jonbindingar är inte dominerande man kan förekomma
- disulfidbindningar 2st -SH/cystein -S-S-
Proteinveckning
Proteinveckning ser genom progressiv stabilisering denaturerad → nativ (funktionell 3d-struktur)
- Exoterm
- hydrofoba effekten bidrar mest
- Går mot energiminimum - så många interaktioner/bindningar som möjligt
- finns flera vägar dit
- Söker efter maximalt antal fördelaktiga interaktioner
- Progressiv stabilisering
- Att pröva sig fram är tidskrävande
- t.ex. polypeptid 100aa
- 3 konfigurationer/aa
- bruteforce år
- tar i själva verket c:a 1sek
Denaturering
Förstörelse ett 3D-proteins struktur
- värme - kinestisk energi (rörelse)
- vid feber rör många proteiner snabbare
- pH - ändrar laddning på R-grupper
- gradienter i ER-golgi
- salt - stör eventuell jonbindningar, men också minska tillgängligt mängd vatten
- det kan skilja lite mellan organeller vid sekretion
- reversibel lägre pH
- karboxylgrupper protoneras och laddningen blir positiv
denatureringen sker väldigt häftigt 1 dalton = av 30000g/mol = 30kDa har kvar eventuella disulfidbryggor, bara svagare interaktioner som påverkas små proteiner kan vecka sig själva, men större behöver hjälp chaperoner
Veckningshjälp
Chaperoner - HSP70 (HeatShock Protein 70 kD)
Heatshock-värmechock, induceras t.ex när vi har feber, då får vi mer av dessa proteiner vi har mer kinetisk energi hydrofoba delar kommer att exponeras mot cytoplasman som inte är bra, då behövs chapeoner för att förhindra aggregering Binder till exponerade hydrofoba delar
- Dessa hitta man i nytranslaterade proteiner (se bild)
- skadade proteiner när veckningen har störts
- felveckade proteiner där det inte gick bra på slutet
- oparade sub-enheter (se kvartärstruktur) finns alltid en viss mängd av HSP70, men vid feber får vi fler då hydrofoba delar exponeras
Chaperonier
Heter HSP60, den är större än chaperoner pga många subenheter
De skapar en skyddad miljö genom att föra polypeptidkedjan till chaperoner, där den kan veckas utan att interagera med andra molekyler i cytoplasman. Inuti chaperonen finns en burk-liknande struktur - stora ringar som omsluter en hålighet med en optimerad miljö för korrekt veckning. Aggregat är skadliga för cellen eftersom de förhindrar proteiner från att utföra sin normala funktion och leder till dysfunktion. Dessutom är de svåra att bryta ned eller eliminera, vilket gör att de kan ansamlas och störa cellens processer - något cellen försöker undvika med hjälp av chaperoner och nedbrytningssystem.
- dubbla ringar med hålighet
- skyddar miljö för veckning
- det kommer ett lock
- rekryteras när HSP70 levererat
- polypeptidkedja Det här kan upprepas flera gånger: polypeptidkedjan förs in i chaperonens ”burk”, locket stängs och proteinet får en ny chans att vikas korrekt i en avskild, skyddad miljö. När locket öppnas igen kan proteinet antingen vara rätt vikt och släppas ut, eller felvikt och skickas in i burken på nytt. Den här cykeln säkerställer att endast korrekt veckade proteiner frigörs i cytoplasman och minskar risken för farliga aggregat.
Sulfhydrylbindningar
- Mellan två cystiner
- Enbart i proteiner som vänds bort från cytoplasman
- de kan sitta i ett membran men vända sig inåt, eller sitta utan på cellen i den ECM eller de kan tom sekreteras och skickas ut från cellen
- cytoplasman har en reducerande miljö vi har gott om föreningar som kan bryta upp den här tillbaka till HSP
- I cytoplasman reducerande miljö -S-S- bryts/reduceras och den reducerade formen -SH när man får tillbaka protonen på den
insulin skickar vi ut ifrån celler både inom och mellan polypeptidkedjor.
Kvartärstruktur
Fler än en polypeptidkedja, då kallas de olika subenheter.
- subenheter: 𝛼, β, delta… i storleksordning är namnen på dem. hålls ihop av:
- hydrofob effekt
- jonbindningar
- vätebindningar
hemoglobin, framtida labb. Två alfa och två beta med fyra subenheter. Men bara två sorters subenheter.
Förutsägelse av proteinstruktur
Exakt samma aa sekvens kan i ett protein vara en 𝛼-helix, i ett annat en β-sträng det beror på resten av polypeptidkedjan vilken miljö den befinner sig. Finns det en lång stränga med hydrofobasträcka, transmembran 𝛼-helix kan förutsägas från längre sträcka opolära aminosyror Nobelpriset 2024 AlphaFold
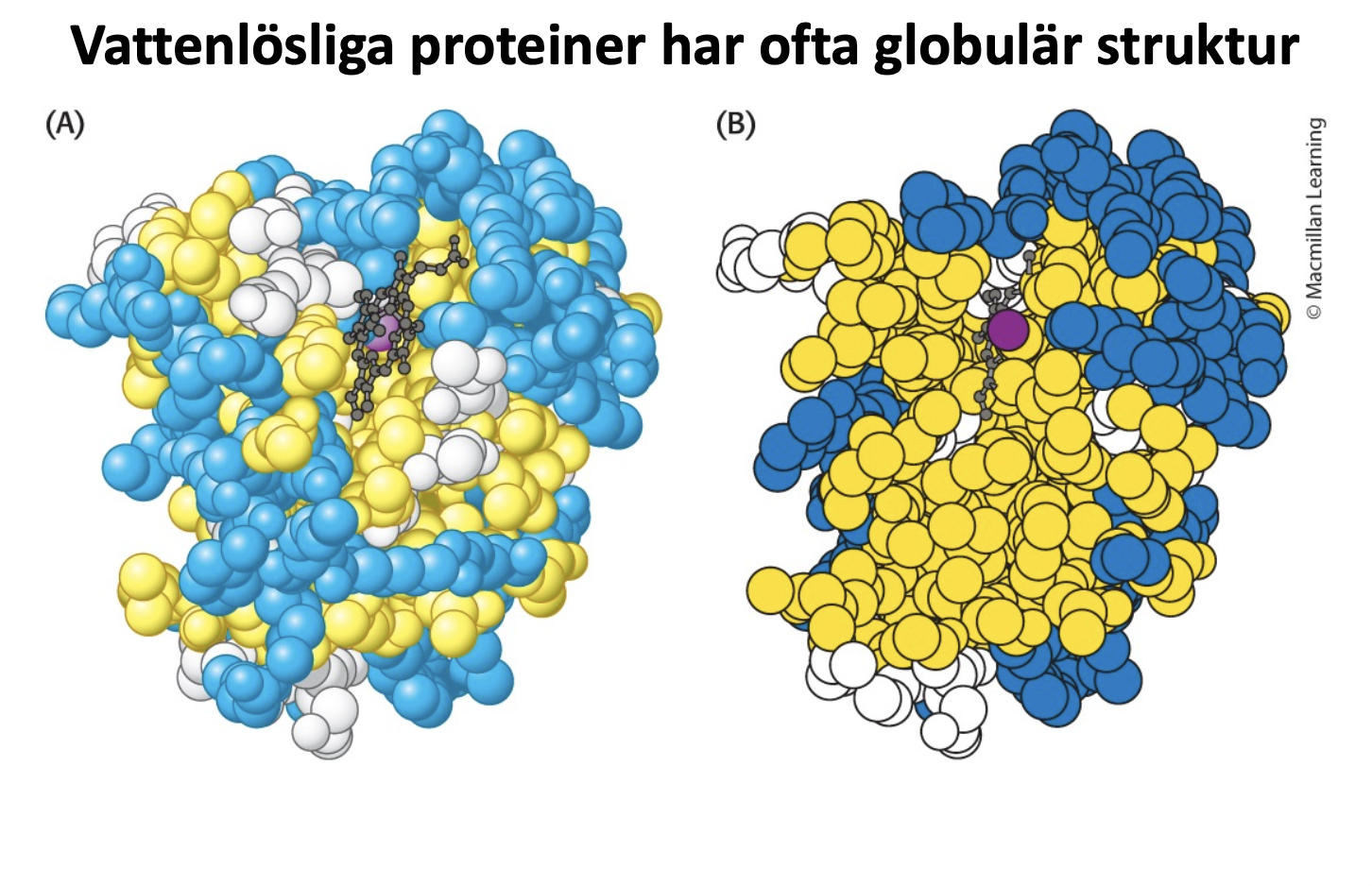 Gula är hydrofoba, lila är ett protein som transporterar något annat
Vätebindningar mellan C=O & N-H i sekundära strukturer minskar deras poläritet, iom att packas centralt i globulära proteiner
väldigt vanlig proteinform
Gula är hydrofoba, lila är ett protein som transporterar något annat
Vätebindningar mellan C=O & N-H i sekundära strukturer minskar deras poläritet, iom att packas centralt i globulära proteiner
väldigt vanlig proteinform
Fibrösa proteiner
 Tvinnade helixar, kollagen och keratin är av de här typen. Ytproteiner hos oss.
Tvinnade helixar, kollagen och keratin är av de här typen. Ytproteiner hos oss.
- Keratin - hår,hud,ull är ungefär 100 nm
- Kollagen - bindväv (brosk, ben, senor), stort och vanligaste ungefär 300 nm
- i sammanhanget är de väldigt stora
varför är proteinstrukturen i hud hår ull sträackbara i olika utsträckning
- för att bindningar är svaga, det gör det elastiskt
Amyloider
Galna kosjukan är på grund av felveckat protein, den nobelprisbelönade teorin, man gav de föda som var nermalda hjärnor från får, det sen överfördes från får till kor.
𝛼-helix rikt protein omvandlas till β-flak rikt protein När det bildar det β-flak rika proteinet kan det polymeriseras felveckas och sen inte gå tillbaka till 𝛼-formen - irreversibelt. dessa sjukdomar sker i CNS, långa fibrer som kan göra hål på celler, leda till de symptom som gör hål i hjärnan och orsakar demens och tidig död
Var hittar man amyloider:
- CNS
- prion
- parkinson
- alzheimers
- finns det mkt amyloider i hjärnan är det allvarligt, kanske inte orsak med det är följden
- Pankreas
- diabetes
- Överallt
- systemisk amyloidos
Du har ett protein som har två olika energinivår som de kan skifta, blir det polymerer kan det inte gå tillbaka till gamla formen. Polymerisering sker mellan cellerna där det går att denaturera
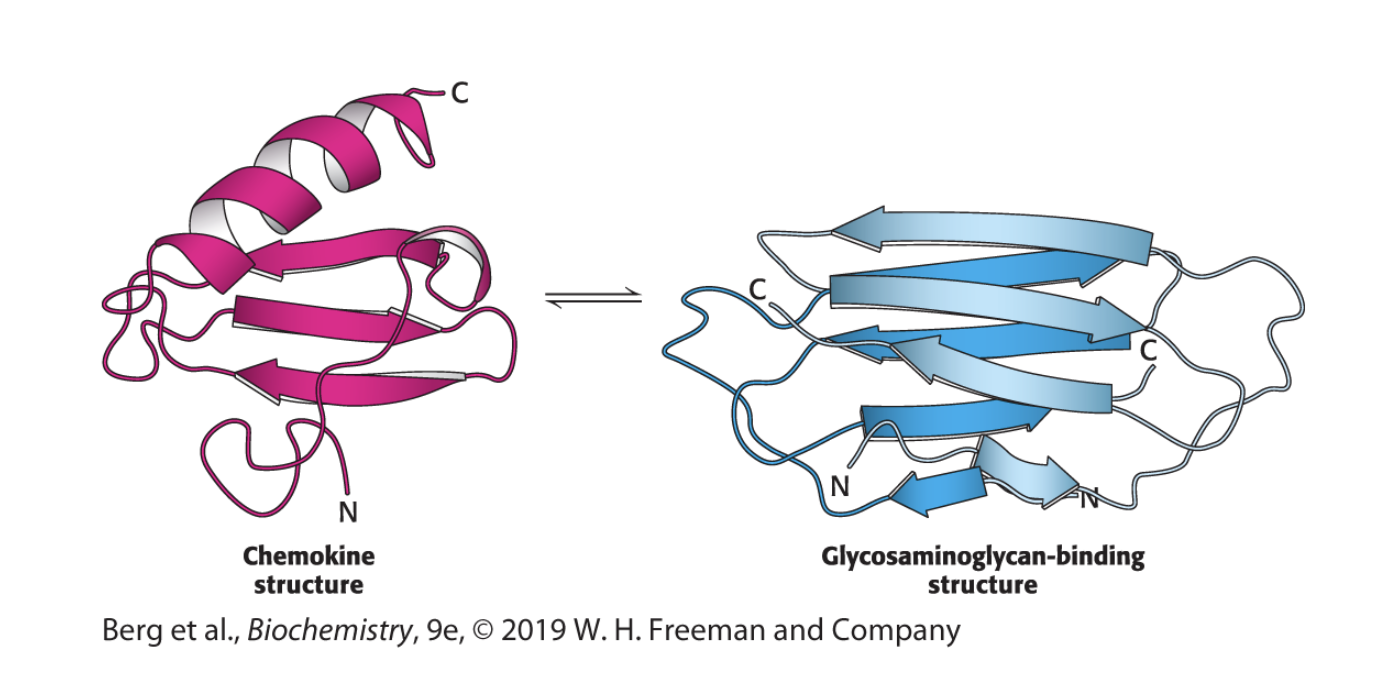
Metamorfa proteiner
Det finns proteiner som växlar mellan de olika formerna, som är funktionella konformationer
De har två energiminimum som ligger väldigt nära varandra, syns på olika platser, öka antalet proteiner per gen
Summary
- minst två betasträngar för ett flak, kan vara nära/långt binds med loopar
- tertriär stabilieras av hydrofob effekt
- domäner är återkommande med specifik funktion
- kotranstionellt
- chaperoniner
- nativ konformation
- denaturering (salt, värme, ph)
- isomeletrisk punkt, skiljer sig på varenda protein
- vid feber får vi fler chaperoner
- 𝛼-, β- namn efter storlekordningen på subenheter
- disulfid är enda kovalenta allt ifrån cytosolen, där kommer den XX direkt
- veckning ser mot energiminimum, kan ha två funktioner på olika platser
- amyloider är också när det finns flera konformationer
- metamorfa är när det är alfa/beta växelvis