-
Zwitterjon är en molekyl som har laddningar men det tar ut varandra totalt. dvs ingen nettoladdning
= alfakol
Kiralt kol har två konfigurationer möjliga, stereoisomerer som är spegelbilder stereoisomerer är spegelbilder
Olika typer av indelning av stereoisomerer R = medsols S = medsols Prioriteringsordning N > C > H i atomnummer, lägst vänds bakåt
Hur ljuset polariserats bestämmer L/D isomerer → planpolariserad
Enbart använda av L-formen i proteiner
Cystein är i R, alla andra S
R/S är medsols/motsols
Alla är R vänder sig åt höger utom Cystein som vänder sig åt vänster
Aminosyror
Vi behöver inte kunna enbokstavskombinationen
Alifatiska
Opolära
Gillar inte vatten, stöts bort, i
- Glycin (Gly)
- Det går inte att få till isometri?
- lätt att packa, inga steriska hinder
- Alanin (Ala)
- metylgrupp som sidokedja
- Valin (Val)
- Leucin (Leu)
- Isoleucin (Ile)
- Metionin (Met)
- Prolin (Pro)
- problematisk, stelare och steliskt hinder
- vända riktning, avsluta någonting för att den är svår att packa
- kommenter: delimitor
- slagit knut på sig själv
Aromatiska
Packas lätt, hydrofoba, opolära, inåt i proteinet
- Fenylalanin (Phe)
- 6 bara kol
- Tryptofan (Trp)
- 5 + 6, Kväve
Alkoholer
Har en -OH grupp, bra för vätebindingar, kan vara donator Polära eftersom de har OH-grupper
- Serin (Ser)
- -OH
- Treonin (Tre)
- Essentiell
- Tyrosin (Tyr)
Sulfhyhlil
Polär
- Cystein (Cys)
- -SH
- unik, disulfidbryggor, två går ihop och skapar en kovalent binding
Amider
Polär
Med en kvävegrupp -NH₂
- Aspargarin (Asn)
- Glutamin (Gln)
Imidazol
Polär
- Histidin (His)
- ligger nära fysiologisk pH
- förekommer också i joniserad form
- de flesta är inte, liten del kommer vara protonerad
Syror
Netto-laddning +1/-1 Ytterligare en syra Negativt laddade
- Aspartat (Asp)
- Glutamat (Glu)
Baser
Netto-laddning +1/-1 Basiska, dvs positivt laddade
- Lysin (Lys)
- Arginin (Arg)
Sju aminosyror har pH-känslighet
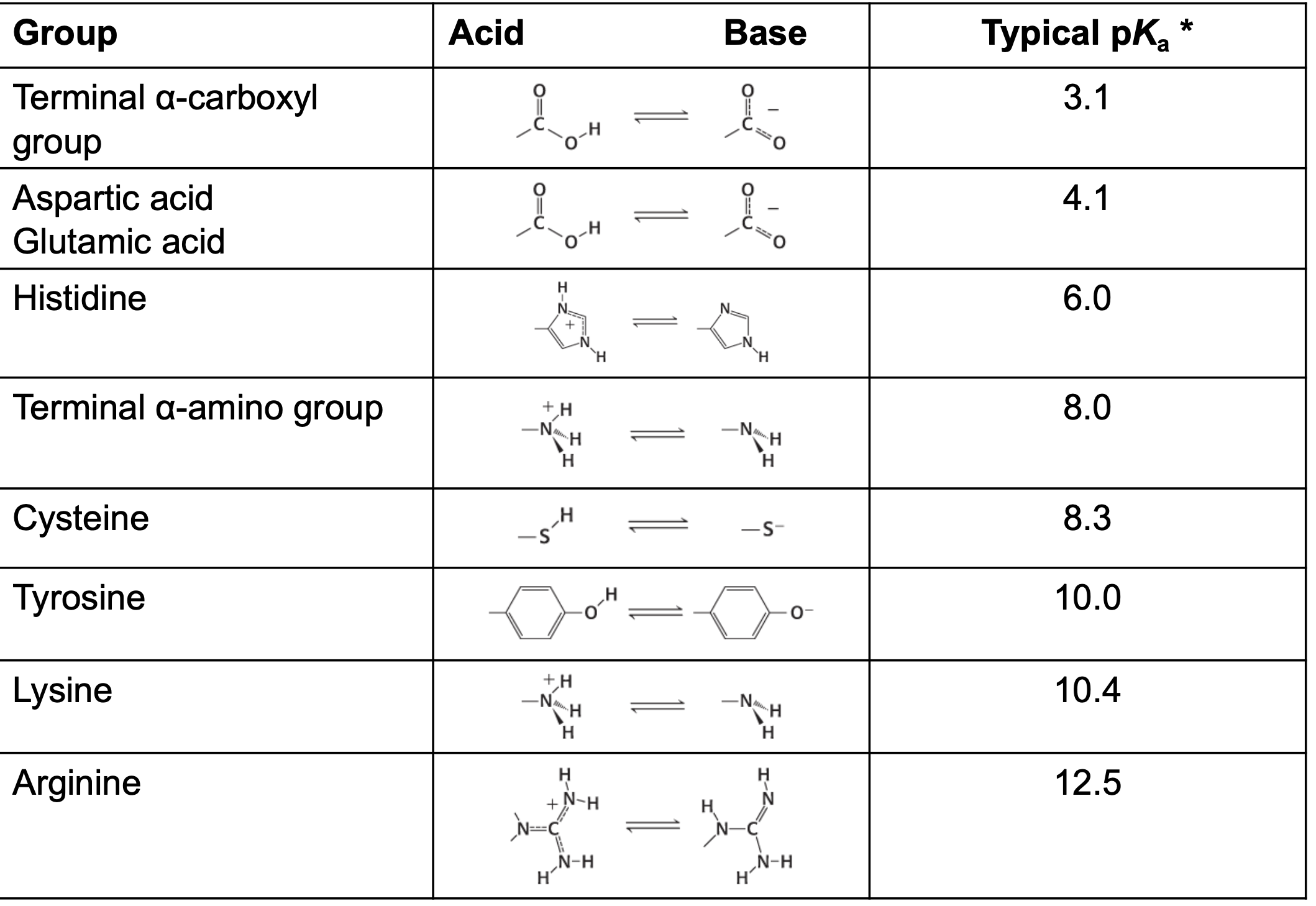
Varför pH känsliga
- buffrar
- strukturen ändras om det
Post-translationella modifieringar
Efter translationen är kvar sker vissa förändringar Fosfolysering, det gör man på alkoholerna (-OH), Ser,Thr,Tyr kommentar: klyvning Glykosylering, N-Asn, O-Ser/Thr
Peptidbindningar
Aminogruppen och karboxylgruppen binder till varandra, aldrig via R-gruppen Sker via kondensationreaktion, dvs vatten, så skapas en amidbindning. Delvis dubbelbildningskaraktär (DVS STEL, går ej att rotera), på grund av resonans vilket gör dem starkare Plan struktur / resonanstabiliserad Runt kirala kolen är rotation möjlig Det gör det möjligt att aminosyrorna kan orienteras i cis eller trans Cis kofniguration, R-grupper från peptider ligger i samma riktning Trans konfiguraition, R-grupper från peptider ligger i olika håll vanligast då får man minst steriska hinder, förenklar packning Prolin är problematisk, där förekommer båda, den kan lika gärna sitta kvar i cis, men annars är det trans
Färgerna måste sitta
- Kväve blått
- Väte vitt
- Kol svart
- Syre rött
- R-gruppen grönt
Proteinveckning
Primärstruktur
- Sekvensen av aminosyror som dyker upp
- Bestäms av genen
- Har en riktning
- den första har en fri aminogrupp, längst till vänster
- den sista har en fri karboxylgrupp
- alla andra har två bindningar
- N-terminalen är den första, fri aminogrupp
- C-terminalen är den sista, fri karboxylgrupp
- Oavsett hur lång kedjan är finns det bara två fria grupper
Sekundärstruktur
- Lokal veckning av delar av polypeptiden
- Stabiliseras av vätebindningar från grupperna i peptidbindningen
-
- vanligast av alla
- helix karakteriseras av en spiral med en konstantdiameter
- kompakt 3.6 aminosyror per varv
- R-grupperna vänds utåt
- Vätebindningar aminosyra + 4 steg längre fram
- Pro bryter helixen
- Val,Thr,Ile - förgrenade är också problematiska, steriskt hinder
- Ser,Asn,Asp - konkurrerar om vätebindingar, stör stabiliteten
- Vad karakteriserar en a-helix som
- genom ett membran
- R-grupperna måste vara hydrofoba
- dvs alifatiska och aromatiska stora majoritet
- ytan
- mot cytoplasma / hydrofila / polära
- från cytoplasma / hydrofob / opolära
- R-grupperna måste vara
- helix med två olika sidor, för att det är hälften i helixen som pekar åt ena hållet och hälften åt andra hållet
- amfipatisk
- genom ett membran
- Omvänd/hårnålsböjd
- byter riktning på polypeptidkedjan
- istället för att para till 4:e aa framför, så binder den med 3:e vilket gör att riktning bryts
- behövs något litet, ofta glycin
summering
kiralt kol vs stereoisomerer varför kan bara ta upp L-protein uppdelning polär/opolär/basisk/sura sen undergrupper av två första laddade bra för jonpassager peptidbindning kondenseras så vatten trans vanligast a-helix är vanligast hårnål parning 1+3