Integrala membranproteiner. Aminosyror med hydrofoba sidokedjor, de har fläckar som är starkt hydrofoba. De sitter hårt associerade till membranet för att få ut de i en lösning får man använda nån form av detergent
Finns olika varianter, detergenter är små amfipatiska molekyler, tex gallsyror
Detergenterna kommer att i de hydrofoba regionera att sätta sig med sina hydrofoba svanser, mot de hydrofoba aminosyrororna. Man maskerar de hydrofoba områderna med hjälp av detergenterna på så sätt kan man få ut dom i en vattenlösning och studera på ett eller annat sätt Men membranproteiner är jobba att hantera, detergentern kladdar gärna ihop sig. De är svårstuderade i allmänhet.
Vanliga protainer har hur många kristallstruktuer som vi vet hur de ser ut. Nästan alla transportproteiner som vi har i blodbanan är hydrofoba på sina ytor
I MB har vi bara kristallstrukturer på säg 20 st, kan inte så mycket om de än.
- Integrala
Här finns det 3 olika klasser/varianter. Den vanligaste är att proteinerna har en eller flera 𝛼-helixar som går genom membranet
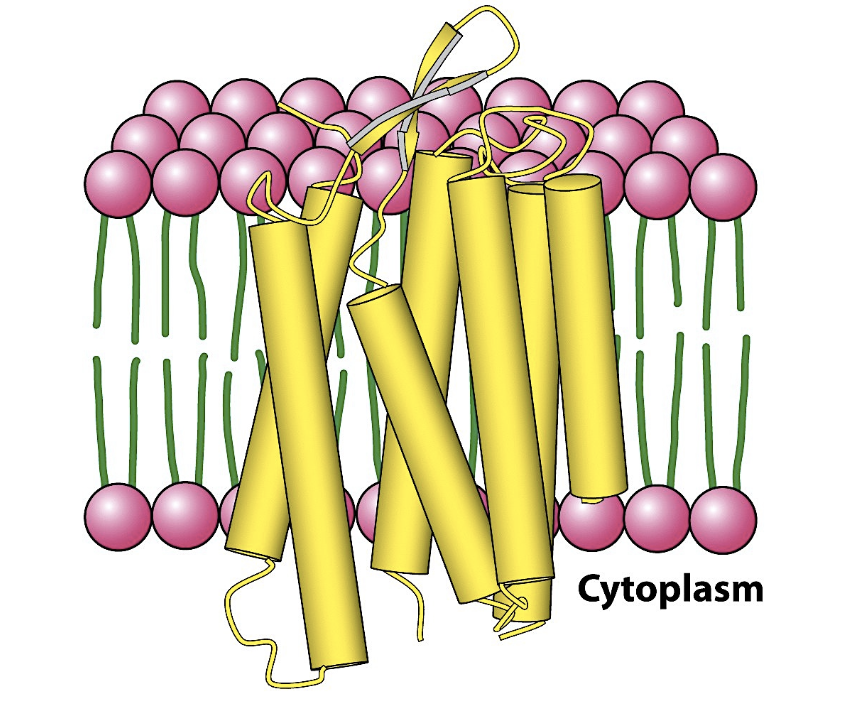 Alfahelixarna bildar i princip en kanal med hydrofoba utåt och hydrofila inåt som tillåter transport, det är vanligt för transportproteiner.
transportproteiner har en eller flera alfahelixar.
Alfahelixarna bildar i princip en kanal med hydrofoba utåt och hydrofila inåt som tillåter transport, det är vanligt för transportproteiner.
transportproteiner har en eller flera alfahelixar.
7TM - seven transmembrane, 7 st alfahelixar som passerar ett membran och bygger upp en kanal.
- transporterar vatten/joner, vad som helst som bromsar av de hydrofoba svansarna. Glykol, aminosyror, vad som helst som har en hydrofil karaktär
längden på dessa alfahelixar är ungefär 20 aminosyror för att kunna spänna över lipidlagret i CM där de flesta har hydrofobkaraktär.
Βeta-barrel
Tunna som är uppbygd av antiparallela β-sheets.
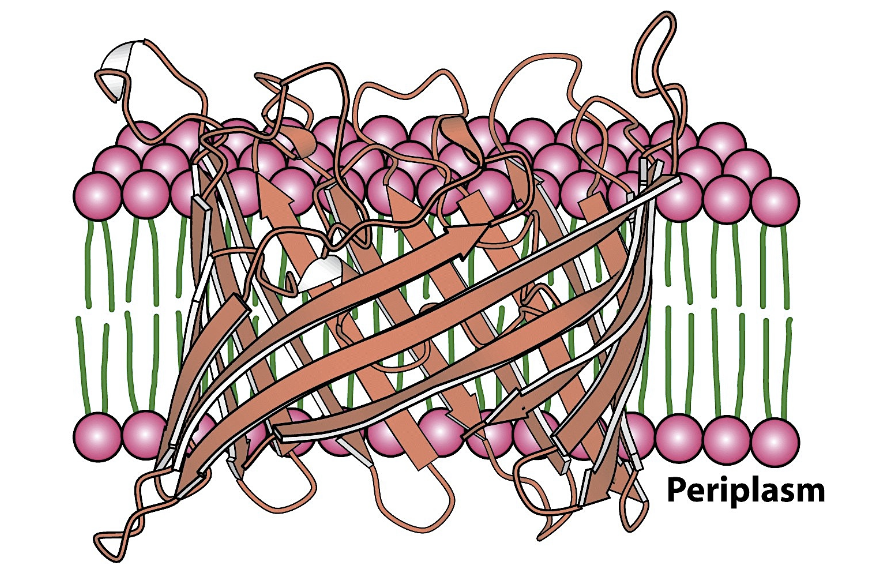
Den är mycket mer ovanlig. De kan fungera som transportprotein.
Partiellt associerade
Finns inget bra namn
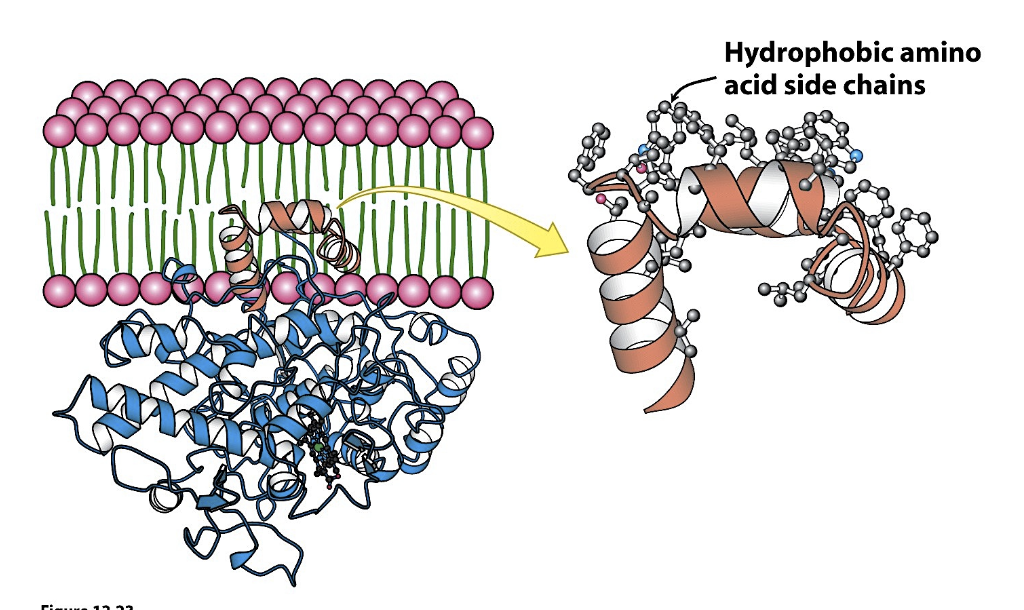 Innehåller en liten hydrofob sekvens, som sitter intrasslade i membramlagret, men går inte igen.
För att få loss dessa måste man använda detergenter, därför handlar de hos de membrana proteinerna
Innehåller en liten hydrofob sekvens, som sitter intrasslade i membramlagret, men går inte igen.
För att få loss dessa måste man använda detergenter, därför handlar de hos de membrana proteinerna
alfa + beta heter transmembrala, ofta är det enzymer som sitter på kanalens insida. Så det snabbt går att använda det som kommer in i cellen.
Utan att saker och ting behvöer diffundera över cytoplasman
Hydropati Plot Aminosyrosekvensen är känd och eftersom majoritetn av transmembrana proteiner är alfahelixar ska vi försöka hitta en sekvens på ungefär 20 hydrofoba aminosyror. Det är det som krävs för att bygga upp en alfahelix.
Finns tabeller över aminorsyror och vad som krävs för att flytta de från en lipid till en vattenmiljö. Finns en tabell i slides 12.2
T.ex. krävs ganska mycket att flytta Phe, men Arg trivs ganska bra i vattenmiljö.
Man tar alla aminosyror och summerar alla nummer ifrån energitabellen,
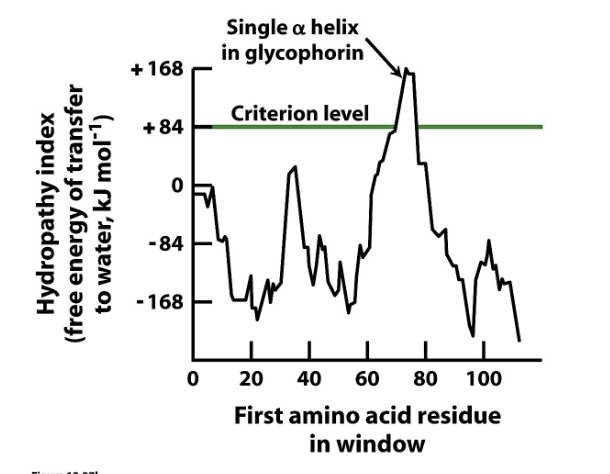 Man tar ett fönster, ett visst 20 antal som man letar efter.
Går det över ett visst värde kan man få en 𝛼-helix, då är det sannolikt att det är ett transmembrant protein.
Man tar ett fönster, ett visst 20 antal som man letar efter.
Går det över ett visst värde kan man få en 𝛼-helix, då är det sannolikt att det är ett transmembrant protein.
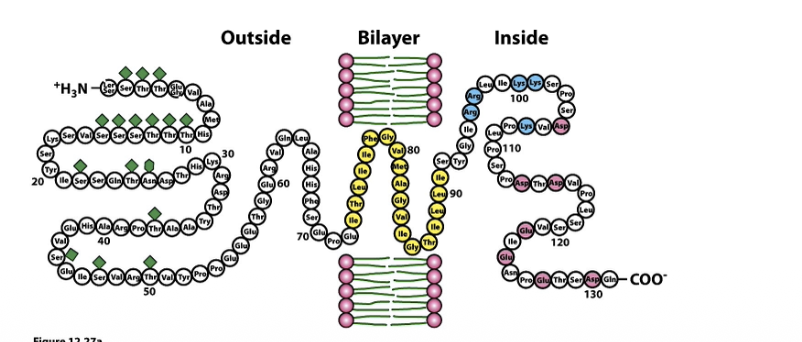 Glykoporin är välstuderat, en topp
Glykoporin är välstuderat, en topp
Man kan ha transmembrala proteiner med många 𝛼-helixar som har en topp per helix och med beta barrels har inga tydliga toppar
Hos möss är 20% av proteinerna troliga membranproteiner. Då börjar man med DNA och kört igenom program som identiferar membraner
Det kommer inte upp på tentan, men ni ska veta att det finns en metod för att sannolikgöra om det är ett transmembralprotein eller inte.
Perifera membranproteiner
-
GTPas, 15C kedja nåra cystein i C-terminall
-
tyrosinkinas, sitter inte stabilt, 14C kedja N-terminal glycin
-
gpi-ankare nånting ganska viktigt, kommer stöta på många gånger, bygger på glycosylfosfatidylinositol-svans C-terminal kovalent bunden till oligsackarid (kolhydrat)
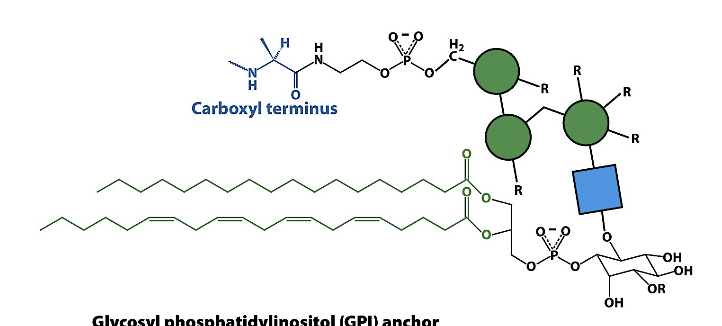 De kan frigöras väldigt snabbt
Finns ett batteri som heter fosfolipaser och lossar proteinet. Proteiner som sitter på det här viset är proteiner som behöver mobiliseras fort, hinner inte gå igenom DNA och proteinsyntes, behöver de på sekunden. Kan ta några timmar att bygga proteiner.
De kan frigöras väldigt snabbt
Finns ett batteri som heter fosfolipaser och lossar proteinet. Proteiner som sitter på det här viset är proteiner som behöver mobiliseras fort, hinner inte gå igenom DNA och proteinsyntes, behöver de på sekunden. Kan ta några timmar att bygga proteiner.
Acetylkolin, muskel någonting GPI-ankare sitter det på
-
Jonbindingar bunda till fosfolipider (elektrostatiska)
-
Associerade till integrala proteiner, cellskellet
Olika celler har olika kolhydrater på sin sida.
Ligandinteraktion med cellytans kolhydrater
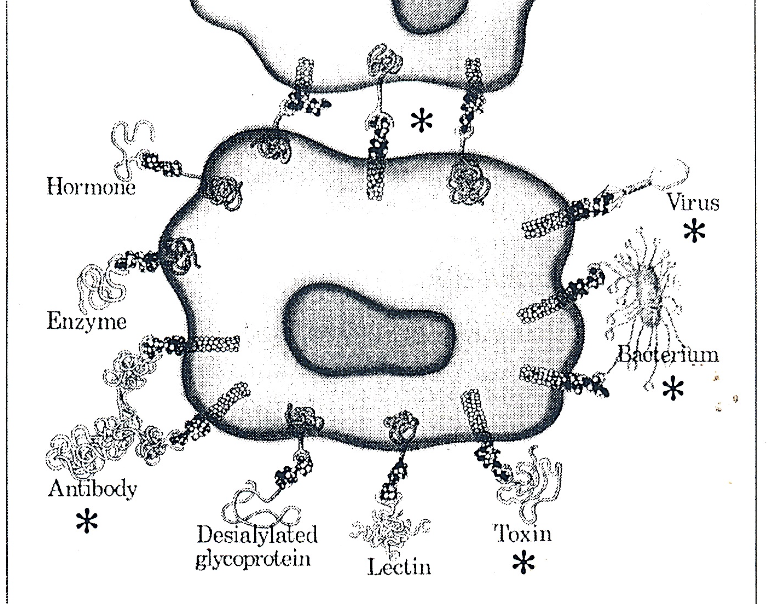
- antikroppar
- hormoner
- enzymer
- andra celler, cell-cell interaktion
- virus/bakterier/toxiner
- exempel: Uropatogen/escherichia/E Coli
- urinvägsinfektionsframkallande bakterie
- den ingår i vår vanliga flora, i tarmen finns det inget den kan binda till
- P-fibria som binder specifikt till Galoaktos 𝛼-4-bindning, de finns inte i tarmen
- om man inte sköter hygienen och får över bakterier från tarmfloran till urinvägarna så kan den binda till sockret i värsta fall kan de gå upp till njurarna
Celladhesionsmolekyler
Integrala membranproteiner som förankrar. celler i varandra eller ECM
- selectins: kolhydrater
- integriner: ECM
- ig-superfamiljen (ICAM): sekvenser som påminner om immunglobilner
- cadheriner: adherens junctions och desmosomer
Selektiner
viktiga proteiner i inflammatoriska reaktioner sitter på leukocyter och binder till kolhydratreceptorer på endotelceller hjälper till att bromsa upp, blir en cell-cell interaktion, leukocyter(neutrofiler) binder till endotelet. Sen när det bromsas upp binder det med integriner, så de vita cellerna kan ta sig ner under endotelet det som kallas diapedesen
Integrin
Viktig familj av proteiner som förankrar endoteler/epitelceller i ECM en 𝛼-subenhet och β-subenhet tvåvärda joner kan binda till olika xxxx binda så att cellerna sitter på sin plats finns många olika varianter
Cadheriner
Adherence junctions och desmosomer cadheriner binder till cadheriner på intilliggande celler Förhindrar att saker läcker mellan celler