Vad som helst som kommer på presentationen kan komma. Ibland vävs avsnitt tillsammans med seminarier osv. Instuderingsfrågorna kommer hjälpa till, konceptuella
Varför studera proteiner?
- Hur ser strukturen ut?
- Vad binder de till?
- Var finns det?
- Sjukdomspåverkan
Klinkien:
- antikroppar och antigen
- ELISA-metoden
- COVID antigen och antikroppar som är intressanta
- misstänkt myelom
Proteom
- Genom vårt totala DNA innehåll - 3 miljarder DNA baser, 23000 gener
- Protem
- alla faktiska proteiner som uttrycks av en given cell, vid en given tidpunkt
- inkluderar modifikationer
- inkluderar interaktioner
- kan skilja sig mycket mellan en given cell och en given tidpunkt
- många kombinationer
- iniaitiv, alphacell
Studera proteiner
- först måste man rena fram ett specifikt protein
- kan separeras (avgörs av aminosyrasekvensen)
- efter storlek
- efter laddning
- efter löslighet
- efter bindningsaffinitet
Preparation av protein
- krossar det och gör det till flytande massa (fiska ut sitt protein ur sin cell)
- kallas även homogenisat (mixern)
- blir en slags gegga/smoothie, vilket gör att de lösgörs
- separerar proteinerna
- via ett centrifugeringssteg
- tunga sakerna hamnar längst ner och lättare högre upp
- i botten av röret heter det: pellet och det ovan kallas supernatat
- egentligen blir det en gradient från minst till störst
- storleksskillnaden är enorm
Kromatografi
Finns olika typer, men först gemensamt:
- köper en form av små beads/kulor, som har olika egenskaper
- man köper beads för den motsvarigheten av kromotografi som man vill utföra
- välja det som passar bäst. kallas för fast fas
- förpackas i en kolonn
- ett långt rör av kulor
- prov in (applicerar sitt prov)
- prov ut som är renat på något sätt
- kräver en fast fas (pekar på mitten av röret)
- själva kulor
- mobil fas
- provet ingår i detta
- en buffert
eulueras = det är då provet kommer ut, betyder olika saker beroende på
Gelfiltrering
Separation med avseende på storlek
Kolonn med porösa kulor (garnnystan)
Stora prover kommer ut före små
Grov och fin separation möjlig
kan behöva utföra det i flera steg
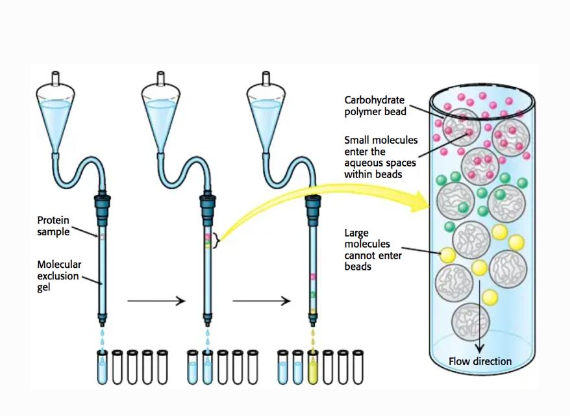 Bromsas in beroende på storlek:
Bromsas in beroende på storlek:
- gul → grön → rosa i hastighet
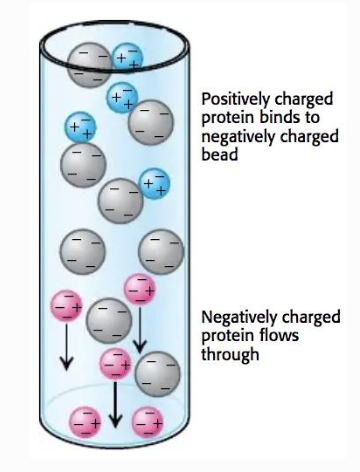
Jonbyteskromatografi
Separation med avseende på laddning Aminosyrasekvensen avgör den totala laddningen hos proteinet
Två typer av kolonner innehåller
- Anjonbytare, binder negativt laddade grupper (positivt laddade går igenom)
- Katjonbrytare binder positit laddade grupper (negativt laddade går igenom)
Om man tillsätter salt på ett kontrollerat sätt, kan man samla upp varenda liten del, då går det lätt att isolera. Saltet gör att man får större kontroll av renhet genom att lägga till en viss koncentration av salt. Ibland kan det finnas 3000 andra proteiner med andra laddningar, som åker rakt igenom. De flesta åker rakt igenom men några få kan sitta kvar, där av kan man använda salt.
Kan kontrollera när det kommer ut (t.ex. via salt) lite mer reningsjobb
Elueras baserat på pH eller salt (ofta båda)
katjon = katt = positiv!
Affinitetskromatografi
Separation med avseende på selektivtet Specifik egenskap (t.ex. gluksmodifikation), för att binda till en kolonn med glukosbindande egenskapr. Exempel:
- På DNA-nivå adderas en sträng av 6st Histidinaminosyror (6xHis tag).
- Dessa binder mycket starkt till en kolonn innehållande nickel (II) joner.
- Proteinet elueras ut med t.ex. imidazol
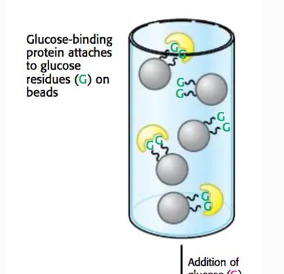
Kanska likt jonbindande, på varje bead sitter något som ditt prov binder till. Precis som jonbyteskromatografi så släpper man ut det som inte är intressant. Två steg:
- först sitter proteinet på bindningarn
- sen sätter man till glukos som konkurrerar ut ditt protein så de släpper
Analys av proteiner
Ofta behöver man göra olika reningssteg. Vi är människor och gör ofta fel, så man behöver verifiera att rätt protein har renats fram.
- vilken renhet som önskas
- vilka egenskapr sin finns
Gelelektrofores
Liknas Plasmid men för protein istället för DNA
En molekyl har en viss nettoladdning och kommer röra sig i ett elektroniskt fält, detta kallas ektrofores. Metoden kallas PAGE ((polyacrylamide gel electrophoresis)
- Polyakrylamiden bildar ett nät där stora bromsar och små slinker igenom
- Alla vandrar mot + polen
- Liknar gelfiltrering men tvärtom
Gelelektrofores: SDS Page
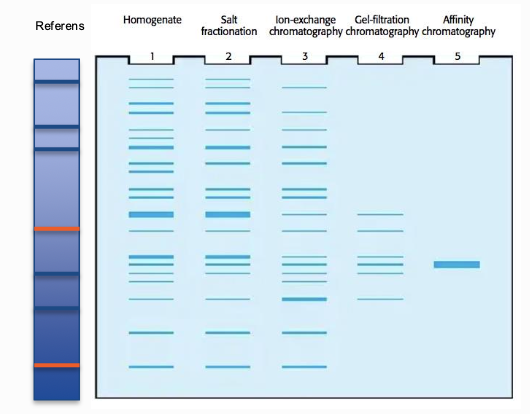 vanligaste typen av gelelektrofores heter SDS Page
vanligaste typen av gelelektrofores heter SDS Page
Lägger till SDS (sodium dodecyl sulfate) ett stort protein kommer binda fler och ett litet protein färre.
- ett proteins laddning är proportionellt mot dess massa (kDa)
- binder till yta, störra yta större SDS, mindre yta mindre SDS
Man blandar proteiner med en känd storlek, som en refens. Det laddas i så-kallade brunnar. När man är klar med körningen, laddar men in en proteinbindande färg.
Varje kolumn är ett reningstillfällende, sen lägger man till mer i steg, så då har
- I första steget har man många sträck, varje streck är ett protein
- I tredje steget, jonbryteskromatografi, här är det väldigt många extra streck, det betyder att proteinet inte är rent.
- I fjärde steget gelfiltreringen blir det få kvar
- I femte blir det affinitetskromotagrfri och efter det finns det bara ett kvar
Gelfiltrering vs. gelelektrofores
| Gelfiltrering | Gelelektrofores |
|---|---|
| Separation av proteiner med avseende på storlek | Separation av proteiner med avseende på storlek |
| Används för proteinrening | Används för proteinanalys |
| Störst först | Minst först |
Antikroppar och antigen
Antikroppar är proteiner som genereras i respons mot främmande element (antigen). Bindning av antikropp till antigen leder till immunrespons som skydar individen mot infektion De grupper eller aminorysor som antikroppen knner igen kallas EPITOP
Polyklonala antikroppar
Det är en mix av antikroppar, känner igen olika epitoper
Monoklonala antikroppar
Känner igen exakt samma epitop av en specifik antigen
antigen = min hand monoklonal = min hands tumme polyklonal = alla fingrar på min hand
ELISA
Enzyme Linked ImmunoSorbent Assay kan användas för att kvantifiera protein (eller antigen) i ett prov En antikropp länkas kovalent till ett enzym-antikropp kan ge färg till ett visst substrat Om ett prov har ett antigen kommer enzym-antikropp binda till antigenet
Indirekt ELISA
detekterar antikroppar
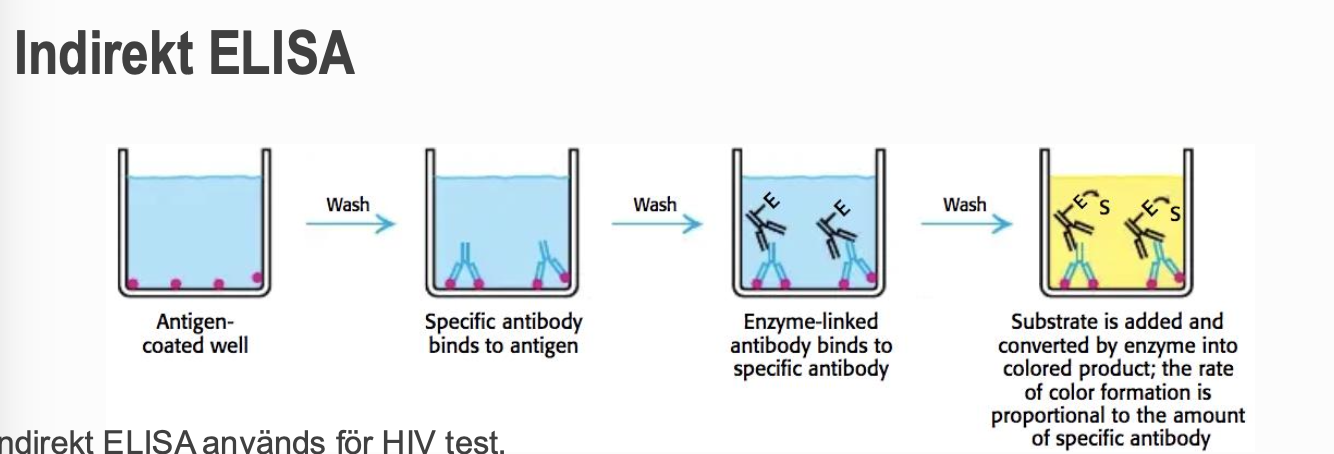
- Antigen fästs i en brunn
- Om patienten har antikroppar för viruset kommer de binda till antigenet
- Om enzymbundet antikropp känner igen den specifika anikroppen
- Substrat adderas → om färg → betyder att personen bär på HIV antikroppar
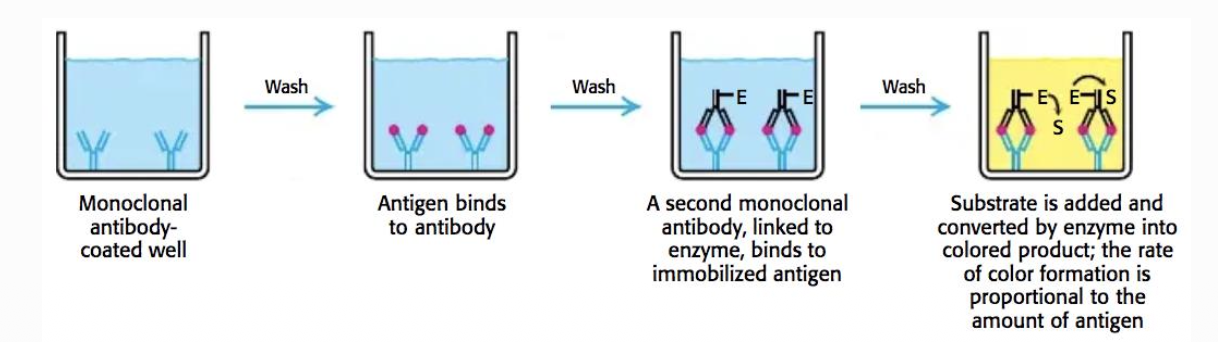
Sandwich ELISA
detekterar antigen
- Används för att detektera antigen, t.ex. för COVID-19
- Antikroppar sätts i en brunn
- Tillsätt prov
- En enzymbärande antikropp (som också binder antigenet) appliceras
- Substrat adderas → om färg → antigen finns i provet
Western blot
Första steget är att köra en SDS-PAGE
- Intresserad av många band
- lösningen är att köra en WB genom att göra över proteiner itll ett membran
- Inkubera med primär antikropp
- Inkubera med sekundär antikropp (som bär ett enzym eller fluorescens) → mät färgskifte Det binder bara mot ett specifikt protein
Masspektrometri
Används för att identifiera peptider och proteiner Kan detektera posttranslationella modifikationer
- t.ex ett socker eller någon irreversibel modifikation Man slår sönder sitt protein i mindre delar, så man får peptider Dessa joniseras och körs i en masspektrometer som heter MALDI-TOF
Den är ganska komplicerad, men tänk mer på användningsområden.
- Kan användas för att sekvenser ett okänt protein
- Kan användas för att. verifiera att rätt protein renats fram
- posttranslationella modifikationer kan identifieras
- Går att skicka till ett labb här i gbg och få information om
- evolutionärt ursprung
- identifier medlemmar i ett stort proteinkomplex
- identifiera signalkomplex (t.ex 50 olika medlemmar)
- sönderdela och kör det mot en databas, vi har hela människans genom och den kan vi översätta till proteinsekvensen. Men vi vet inte proteom, specifika för en viss cell.
Strukturbestämming av protein
Vad föreläsaren jobbar med. Vill veta hur olika proteiner ser ut. Trots AI svårt att förutsåp den exakta strukturen. Men det brukar finnas några överraskningar. Vi vill fortfarande bestämma strukturen experimentellt Viktigt för läkemedelsutveckling Läkemedelsbolag vill veta hur liganderna interagerar med ett protein. Kan komma på nya proteiner som kan binda till ditt protein
NMR
Baserat på är att atomkärnor är nära varandra och magnetiska Det finns inte så många isotoper har den magnetismen. Men väte har det! Man tillför en elektromagnetisk puls, då kan man få en resonans. Då kan man undersöka protonens omgivning. Men kan undersöka en proteins omgivning per gång → en dimensionell NMR NOESY: undersöker protonpar som är nära varandra. Det kan man använda för att få information om proteinens 3D-struktur. Det finns många limiteringar i den här typen av experiment. Nackdelen är att man bara kan titta på små proteiner < 50 kDa
Röntgenkkristallografi
Kristalliserar proteinet som är tidskrävande ofta
Exponerar mot röntgenstrålning och det mönstret som man får. Sen med hjälp av dator kan man ta reda på vad det är för protein. Ju högre upplösning ju högre detalj.
Ersatts av
Kryo-Elektronmikroskopi
Mikroskopbaserad metod, behöver inte kristallisera sina proteiner istället. Inga specifika egenskapr hos proteinet behövs )inga kristaller, inga specifika isotoper
Mycket snabb utvecling de senaste 5-10 åren.
Använder sig av framrenat protein, man fryser det med flytande helium och sen så sätter man det under sitt mikroskop. Varje enskild proteinartikel kommer man sätta samman i en 3d-struktur.
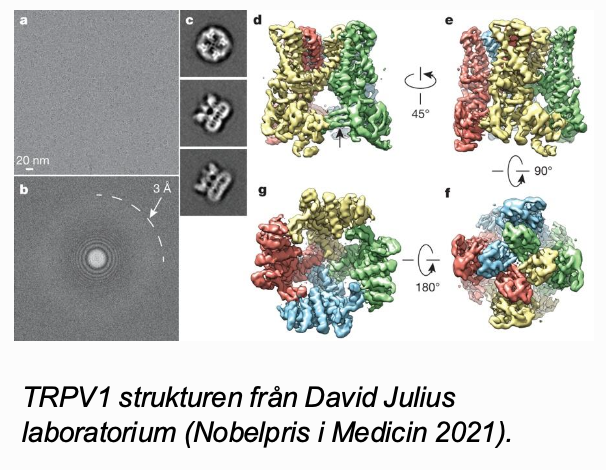 en sån här molekyl som hjälper er att känns skillnaden i temperatur.
en sån här molekyl som hjälper er att känns skillnaden i temperatur.